La dermatite da stasi è una malattia infiammatoria cronica della pelle degli arti inferiori.
La patologia verifica tipicamente negli individui più anziani ed è la manifestazione cutanea dell’ipertensione venosa causata dal reflusso venoso. Tale flusso sanguigno venoso retrogrado è il risultato di valvole venose incompetenti, distruzione della valvola o ostruzione venosa. La dermatite da stasi è eczematosa. L’associata compromissione delle valvole venose può causare gonfiore delle gambe, portando a condizioni gravi tra cui ulcerazioni venose.
Autori:
American Journal of Clinical Dermatology (2023)
Diagnosi difficile.
La diagnosi può essere difficile a causa della sua somiglianza clinica con altre condizioni della pelle e dello scarso riconoscimento clinico da parte dei medici.
Il trattamento.
I capisaldi del trattamento della dermatite da stasi sono la terapia compressiva per migliorare il dolore e il gonfiore, i trattamenti topici per alleviare i cambiamenti cutanei secondari e le opzioni di trattamento interventistico per correggere le cause alla base del reflusso venoso.
Nuovi approcci terapeutici.
Dato il ruolo centrale dell’infiammazione degli arti inferiori nel guidare i cambiamenti cutanei caratteristici della dermatite da stasi, nuovi approcci terapeutici mirati all’infiammazione sono in fase di valutazione clinica nei pazienti con dermatite da stasi.
La patologia.
La dermatite da stasi è una malattia della pelle che può colpire una persona per lungo tempo. Colpisce le gambe delle persone anziane che hanno una malattia chiamata insufficienza venosa cronica. Questo è quando le vene di una persona hanno difficoltà a inviare il sangue dagli arti al cuore. La dermatite da stasi è causata dall’aumento della pressione all’interno delle vene di una persona. I suoi segni e sintomi sono scolorimento della pelle, prurito, secchezza e desquamazione e possono essere simili ai segni e sintomi della cellulite e della dermatite allergica da contatto. La cellulite è una comune infezione della pelle causata da batteri. La cellulite provoca arrossamento, gonfiore e dolore. La dermatite allergica da contatto è un’eruzione cutanea pruriginosa causata dal contatto con qualcosa che irrita la pelle. La dermatite da stasi viene solitamente diagnosticata dopo che un operatore sanitario ha esaminato la pelle della persona e la sua storia medica. Il trattamento per la dermatite da stasi dovrebbe trattare l’insufficienza venosa cronica che causa la malattia. Dovrebbe anche trattare le lesioni cutanee causate dalla dermatite da stasi. Un modo per trattare la dermatite da stasi è ridurre il dolore e il gonfiore. Questo viene fatto applicando pressione con calze a compressione o bende. La chirurgia minore può trattare l’insufficienza venosa che causa la dermatite da stasi. Nessun trattamento è stato approvato per i sintomi cutanei associati alla dermatite da stasi. Devono essere sviluppati nuovi modi per trattare tali sintomi.
Introduzione.
La statis dermatitis (DS), nota anche come eczema venoso, eczema da stasi, SD venosa o dermatite gravitazionale, è una malattia infiammatoria cronica della pelle guidata da un’insufficienza venosa cronica sottostante che colpisce tipicamente gli arti inferiori degli individui più anziani [1, 2]. Nella DS, le alterazioni della funzione del plesso venoso profondo agli arti inferiori causano un riflusso del sangue al sistema venoso superficiale, portando a ipertensione venosa, infiammazione cutanea e una serie di potenziali complicanze, comprese le ulcere venose [3]. Questa recensione descrive l’incidenza, la presentazione clinica, la diagnosi, la patogenesi e il trattamento della SD. La letteratura è stata selezionata tramite una ricerca PubMed di alto livello utilizzando parole chiave correlate alla SD, come “dermatite da stasi”, “ulcere da stasi”, “ulcere venose”, “ipertensione venosa”, “dermatite da stasi venosa”, “eczema venoso”, ” insufficienza venosa cronica”, “malattia venosa cronica” e “insufficienza venosa cronica”.
Epidemiologia.
La malattia venosa cronica, compresa l’insufficienza venosa cronica, è una malattia comune che aumenta con l’età ed è più diffusa nelle donne [4, 5]. Le stime per la prevalenza dell’insufficienza venosa cronica variano ampiamente, evidenziando una lacuna di conoscenza nei dati epidemiologici esistenti, con i numeri osservati che spesso dipendono dalle caratteristiche cliniche e dagli stili di vita delle popolazioni esaminate. Geograficamente, la più alta prevalenza riportata di insufficienza venosa cronica è nei paesi occidentali, con un range da < 1 a 40% nelle donne e da < 1 a 17% negli uomini [1, 6]. Uno studio dell’Arabia Saudita ha stimato la prevalenza complessiva dell’insufficienza venosa cronica in circa il 45,6% [7]. Uno studio scozzese ha rilevato che la prevalenza aggiustata per l’età dell’insufficienza venosa cronica è del 9% negli uomini e del 7% nelle donne, con prevalenza che aumenta con l’età [8]. In uno studio trasversale sull’insufficienza venosa cronica in pazienti in 24 città italiane, solo il 22,7% di circa 5200 partecipanti adulti non ha mostrato segni visibili della malattia [9]. Si stima che tra i 2 ei 6 milioni di individui negli Stati Uniti soffrano di forme avanzate di insufficienza venosa cronica, inclusi gonfiore e alterazioni della pelle, con circa 500.000 individui che presentano ulcere venose dolorose [10]. Circa il 37-44% degli individui con ulcere alle gambe era stato diagnosticato con SD [11]. SD è una presentazione cutanea avanzata dell’insufficienza venosa cronica che è più comune nei pazienti più anziani; l’età è positivamente correlata con il numero di segmenti venosi insufficienti [2]. In uno studio, SD è stata identificata nell’1,4% di 773 individui di età ≥ 15 anni che avevano vene varicose [12]. In un altro studio, SD è stata trovata nel 6,2% di 4099 individui di età ≥ 65 anni [13]. Studi simili hanno trovato una prevalenza SD del 5,9% in 68 individui con un’età media di 74 anni (range 50-91), aumentando al 6,9% in 584 individui con un’età media di 80 anni (range 55-106) [2] . Con l’aumentare dell’età della popolazione statunitense, l’aumento dei tassi di obesità e stili di vita più sedentari, si prevede che la prevalenza dell’insufficienza venosa cronica (e, di conseguenza, della DS) aumenterà.
Le ulcerazioni venose degli arti inferiori sono una complicanza significativa nei pazienti con insufficienza venosa avanzata. Sebbene la terapia compressiva rimanga il trattamento più frequentemente utilizzato per le ulcere venose, con la guarigione delle ulcere riportata in circa il 70% dei pazienti aderenti al trattamento, una parte significativa dei pazienti non risponde completamente a questo trattamento [14]. Le calze compressive possono essere troppo dolorose da indossare per i pazienti con ulcere da stasi, quindi possono essere necessari trattamenti chirurgici (vedi Sez. 7 sui trattamenti). Dopo la guarigione, la frequenza a 5 anni per la recidiva delle ulcerazioni venose varia tra il 26 e il 51%, con il valore esatto che dipende dal grado iniziale di ulcerazione [15]. Inoltre, la guarigione non garantisce il pieno ripristino della corretta funzionalità nei pazienti, né la risoluzione del disagio o del dolore.
Presentazione clinica.
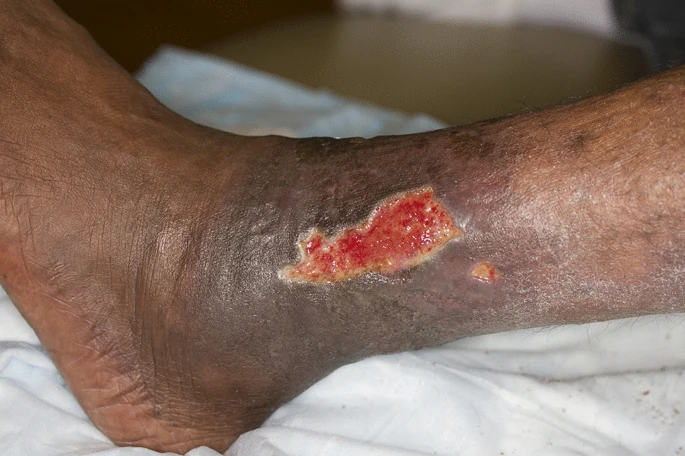
La SD, come manifestazione cutanea di insufficienza venosa cronica causata da flusso sanguigno venoso retrogrado, è classificata come C4 (alterazioni della pelle e del tessuto sottocutaneo secondarie a malattia venosa cronica) nella classificazione CEAP (Clinical-Etiology-Anatomy-Pathophysiology) dei disturbi venosi [1, 16]. Questo è uno standard accettato a livello internazionale per descrivere i pazienti con disturbi venosi cronici in base alle manifestazioni cliniche, all’attuale comprensione dell’eziologia della malattia, all’anatomia coinvolta e alla sottostante patologia venosa [16]. La presentazione clinica tipica comprende chiazze e placche eritematose ed eczematose scarsamente delimitate degli arti inferiori, con la regione del malleolo mediale che è la più frequentemente e gravemente coinvolta [1, 2]. La natura eczematosa della SD è rappresentata da desquamazione, eritema e xerosi della cute. Questi cambiamenti della pelle possono estendersi al piede e al ginocchio. I sintomi caratteristici includono prurito (prurito) sulla caviglia mediale (che può estendersi allo stinco), dolore, infiammazione della lesione, desquamazione e cambiamenti e ispessimento del colore della pelle [1, 3]. Il prurito è il sintomo più fastidioso, che influisce sulla qualità della vita del paziente (QOL) e porta a graffi che possono aggravare le ferite e aumentare il rischio di infezione della pelle. Il graffio cronico dovuto al prurito può anche provocare ispessimento della pelle e lichenificazione [1, 17]. Anche le macchie brune (iperpigmentazione), risultato della deposizione di emosiderina, che è il sottoprodotto dell’emoglobina degli eritrociti stravasati, rappresentano un classico segno cronico (Fig. 1). La SD può essere associata ad altre presentazioni tipiche della malattia venosa cronica, inclusi crampi, dolore/dolore alle gambe, prurito, gonfiore e lipodermatosclerosi [2]. A causa della rottura della barriera epidermica, possono verificarsi anche infezioni secondarie, che portano a infezioni superficiali come impetiginizzazione, cellulite ed erisipela. Sia la cellulite che l’erisipela sono infezioni della pelle causate da batteri con la differenza principale che è la profondità dell’infezione: l’erisipela è più superficiale, colpisce marcatamente il viso e gli arti inferiori, mentre la cellulite raggiunge il derma più profondo e gli strati di grasso sottocutaneo, interessando marcatamente il palmo della mano mani e gli arti inferiori [1, 18, 19]. È importante sottolineare che, se le alterazioni venose sottostanti non vengono trattate, il paziente con malattia venosa può sviluppare ulcerazioni venose croniche insieme a stillicidio ed eritema (Fig. 2) [2]. I pazienti con SD possono anche sviluppare acroangiodermatite (pseudo-sarcoma di Kaposi) e può essere necessaria una biopsia per differenziarlo dal sarcoma di Kaposi [1, 2, 20].
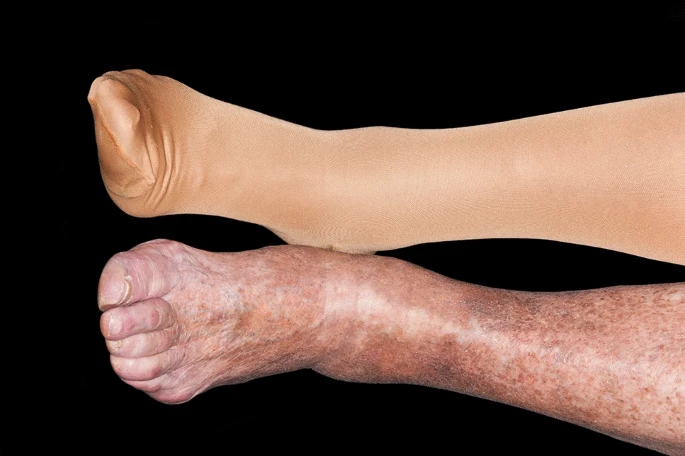
È clinicamente importante distinguere tra SD acuta e cronica. La DS acuta è spesso osservata con edema acuto o in peggioramento ed è caratterizzata da eritema sostanziale, bolle, pianto e vescicole (indicate come riacutizzazione). Sia la SD cronica che quella acuta sono spesso diagnosticate erroneamente come cellulite bilaterale. La SD cronica si presenta spesso con iperpigmentazione ed eritema scarsamente delimitati che sono collegati all’edema cronico e all’infiammazione sottostante degli arti inferiori. I pazienti con SD cronica possono sviluppare riacutizzazioni acute che si manifestano clinicamente come peggioramento dell’eczema, con segni di infiammazione, come dolore e gonfiore. La lipodermatosclerosi che si osserva nella DS cronica è una grave panniculite fibrosante del tessuto sottocutaneo e può portare a un aspetto da “bottiglia di champagne rovesciata” della lipodermatosclerosi della gamba. In contesti di DS acuta, la lipodermatosclerosi può presentarsi con placche o noduli sottocutanei dolorosi [1, 3].
Peso della malattia.
La malattia venosa cronica, inclusa la SD, è associata a dolore e una ridotta qualità della vita, incluse limitazioni nella funzione fisica, nel sonno e nella mobilità. Le riduzioni del funzionamento fisico e della mobilità possono limitare la capacità del paziente di applicare farmaci topici o di indossare o togliere calze compressive, peggiorando così la situazione. I pazienti con SD riferiscono anche isolamento sociale e depressione [4, 14]. Il benessere emotivo e sociale può essere influenzato dai cambiamenti estetici della pelle (inclusi iperpigmentazione e desquamazione) tipicamente osservati [2, 21]. L’iperpigmentazione post-infiammatoria può persistere anche dopo che altri segni e sintomi si sono risolti con la terapia [2]. Uno studio su 2404 pazienti che utilizzava il questionario generico Medical Outcomes Study 36-Item Short-Form General Health Survey ha identificato una correlazione significativa tra la gravità della malattia venosa e il declino della QOL del paziente affetto [21]. Allo stesso modo, è stata trovata una correlazione tra classe CEAP e QOL utilizzando un questionario specifico per la malattia [22]. Uno studio che ha esaminato la qualità della vita in pazienti con insufficienza venosa avanzata ha rilevato che i pazienti soffrivano di forti dolori e disagi, con un livello complessivo di indipendenza dei pazienti inferiore a quello degli individui sani [14]. Come notato in precedenza, il prurito è uno dei sintomi fastidiosi riportati nella SD. In un sondaggio che ha coinvolto una popolazione anziana, SD è stata la dermatite più comunemente segnalata per causare prurito [23]. I pazienti con prurito degli arti inferiori hanno mostrato una qualità della vita correlata alla salute inferiore e valutazioni del dolore alle gambe più elevate rispetto a quelli senza prurito [24]. Ad aggravare questo problema, il prurito nella SD può essere refrattario alle terapie convenzionali [17].
Le malattie venose croniche, inclusa la SD, hanno un impatto diretto sulle risorse sanitarie e sono associate a una perdita di giornate lavorative annuali e a un aumento dei costi complessivi di trattamento. Negli Stati Uniti, i costi di trattamento delle malattie venose sono compresi tra 2,5 e 3 miliardi di dollari USA, con una perdita di 2 milioni di giorni lavorativi all’anno [25]. Complessivamente, le malattie venose croniche rappresentano l’1-3% del budget sanitario totale nelle nazioni con sistemi sanitari sviluppati [4], sebbene non esista una solida letteratura che descriva l’impatto economico della SD. Inoltre, l’insufficienza venosa cronica in generale è spesso sottodiagnosticata e sottotrattata per periodi di tempo prolungati, e lo scarso riconoscimento della SD all’interno del sistema sanitario e la mancanza di servizi dermatologici in molti ospedali, pronto soccorso e strutture di cure urgenti aggravano ulteriormente il peso il paziente [26, 27]. Diversi specialisti sanitari (inclusi medici generici, dermatologi, geriatri, chirurghi vascolari e specialisti della cura delle ferite) possono essere coinvolti nell’interazione iniziale e nella successiva cura del paziente.
Diagnosi e Istopatologia.
Diversi fattori di rischio sono stati stabiliti con lo sviluppo di insufficienza venosa che porta a SD, tra cui età avanzata, sesso femminile, gravidanza, obesità, posizione seduta o in piedi prolungata, insufficienza cardiaca e storia familiare di malattia venosa (Tabella 1) [1, 28]. L’associazione con la gravidanza e l’obesità è dovuta allo stress extra posto sugli arti inferiori del paziente [1, 3]. I pazienti che non sono in grado di muoversi possono manifestare edema alle gambe causato da stasi venosa dovuta all’immobilità stessa e non a complicanze venose anatomiche [29]. I fattori di rischio come uno stile di vita sedentario e l’obesità possono essere affrontati, con potenziale miglioramento della malattia.
La SD viene tipicamente diagnosticata mediante valutazione clinica della pelle interessata e anamnesi [1, 28]. Se la diagnosi iniziale non è conclusiva, gli ultrasuoni duplex possono essere utilizzati per rilevare la direzione del flusso sanguigno, valutare il reflusso venoso e identificare potenziali ostruzioni venose. L’uso diffuso dell’ecografia duplex è supportato dalla sua accuratezza, non invasività ed efficacia in termini di costi [1, 30]. La tomografia computerizzata e la risonanza magnetica possono anche essere utilizzate per rilevare ostruzioni nelle vene prossimali e nelle strutture circostanti [2]. Una diagnosi di SD può essere confermata attraverso la biopsia e la dimostrazione delle classiche caratteristiche istologiche della SD, inclusi macrofagi carichi di emosiderina, fibrosi dermica, eritrociti stravasati, infiltrazione linfocitica perivascolare e proliferazione di vasi sanguigni dilatati nel derma papillare [1]. Le biopsie sono generalmente evitate perché il flusso sanguigno alterato nelle aree della pelle colpite può causare una scarsa guarigione e lo sviluppo di ulcere [1, 28].
Diversi disturbi cutanei possono presentarsi in modo simile alla SD, portando a diagnosi ritardate o imprecise e conseguente cattiva gestione della malattia e l’impatto associato sull’ansia del paziente e sui costi sanitari. In effetti, oltre il 10% delle diagnosi di cellulite non sono corrette, con la DS che è la condizione erroneamente diagnosticata più comune. La cellulite è associata a un trauma precedente o a una barriera epiteliale interrotta nella regione interessata, caratterizzata da placca eritematosa unilaterale insieme a dolorabilità, gonfiore e calore [1]. La cellulite è spesso accompagnata da una varietà di sintomi sistemici, tra cui lieve leucocitosi, febbre e, meno comunemente, linfoadenopatia regionale e/o linfangite ascendente [1, 31]. Le indicazioni di cellulite includono anche una storia di progressione acuta e miglioramento con gli antibiotici [2]. Tuttavia, la SD è spesso bilaterale, non associata a dolorabilità significativa e cronica e si verifica frequentemente con edema focheggiante [31]. Tuttavia, si possono osservare presentazioni unilaterali di SD quando l’insufficienza venosa è limitata a un’estremità [1]. A causa delle molte somiglianze tra cellulite e SD, i pazienti con SD sono spesso trattati per la cellulite ricorrente. Dato che la cellulite è potenzialmente un’emergenza medica, una diagnosi errata può comportare un ricovero non necessario e l’esposizione agli antibiotici. Non sorprende che la consultazione precoce con un dermatologo abbia dimostrato di migliorare l’accuratezza della diagnosi delle malattie infiammatorie della pelle nei pazienti ospedalizzati [1, 32].
La dermatite allergica da contatto è anche un fattore di rischio nei pazienti con una storia più lunga di SD e ulcerazioni ed è spesso scambiata per SD [1, 31, 33]. A causa della rottura della barriera epidermica nei pazienti con SD e dell’uso frequente ed esteso di trattamenti topici contenenti ingredienti sensibilizzanti, la dermatite allergica da contatto può presentarsi su uno sfondo di SD, complicando ulteriormente la diagnosi. Il patch test è spesso necessario per confermare la dermatite allergica da contatto [1, 2]. La storia di un paziente, inclusa la precedente applicazione di prodotti, calze e medicazioni, è essenziale per determinare quali allergeni sottoporre a patch test [1]. L’autoeczematizzazione, nota anche come reazione id, che è l’insorgenza acuta di un’eruzione altamente eritematosa, pruriginosa, morbilliforme o papulovescicolare dovuta all’esposizione a uno stimolo, si verifica comunemente con SD [1, 34].
Anche le dermatosi purpuriche pigmentate (PPD) e la vasculite indotta dall’esercizio fisico possono assomigliare alla SD a causa della loro principale caratteristica clinica di petecchie puntate secondarie agli eritrociti stravasati [1, 35]. Come la DS, le PPD sono limitate bilateralmente agli arti inferiori e sono spesso croniche con esacerbazioni ricorrenti. La deposizione di emosiderina si trova nel derma superficiale nei PPD, mentre la deposizione è più profonda nella SD [1, 2]. Altri imitatori della SD includono la dermatite atopica (AD), la dermopatia diabetica e l’eczema xerotico [1, 36]. Conoscere la comparsa di tali condizioni, oltre a perseguire il corretto iter diagnostico che includa sia la storia che la presentazione clinica, è importante per diagnosticare correttamente i disturbi cutanei associati all’infiammazione degli arti inferiori [1, 28]. Inoltre, i medici generici potrebbero non riconoscere i disturbi venosi o apprezzarne la gravità e, di conseguenza, potrebbero non indirizzare il paziente a uno specialista [37].
Patogenesi.
Il reflusso venoso che guida l’ipertensione venosa può essere il risultato di valvole venose incompetenti, ostruzione del flusso venoso o insufficienza della pompa muscolare degli arti inferiori e può verificarsi nei sistemi venosi superficiali o profondi [1, 4]. In uno studio su pazienti con malattia venosa cronica, l’incompetenza valvolare primaria era presente nel 70-80% dei casi; l’incompetenza valvolare era dovuta a trauma o trombosi venosa profonda nel 18-25% dei casi [4]. Nell’insufficienza venosa cronica, l’aumento dell’ipertensione venosa avvia cambiamenti nel tessuto sottocutaneo locale e nella pelle, inclusa l’attivazione delle cellule endoteliali, stravaso di globuli rossi e macromolecole, diapedesi dei leucociti e alterazioni infiammatorie che sono spesso notate a livello delle caviglie e sopra di esse. 38]. C’è un accumulo di prove cliniche a sostegno del concetto che l’ipertensione venosa causi SD. Uno studio che ha esaminato 360 arti inferiori ha indicato una correlazione positiva tra aumento della pressione venosa ambulatoriale e grave danno cutaneo [39]. In un altro studio, l’ipertensione venosa è risultata essere l’unica causa plausibile di SD in pazienti con insufficienza venosa superficiale, con patch test negativo e senza insufficienza delle vene profonde. È interessante notare che, in questo secondo studio, l’intervento chirurgico mirato alla pressione venosa ha portato alla completa e rapida risoluzione della SD per tutti i pazienti sottoposti a intervento chirurgico [40].
In termini sia di patogenesi della SD che di sviluppo di terapie efficaci, è importante capire che l’infiammazione causa i cambiamenti cutanei caratteristici della SD [2, 4]. L’accumulo di leucociti nel microcircolo delle estremità con ipertensione venosa è stato riportato negli anni ’80 e tale intrappolamento leucocitario è ora considerato tipico delle prime fasi dell’insufficienza venosa cronica, in particolare nella SD [40, 41]. Gli studi hanno dimostrato che il sangue passivamente dipendente nei piedi di individui con malattie venose croniche ha bassi livelli di leucociti, suggerendo l’accumulo di leucociti nelle regioni di alta pressione venosa, portando alla risposta infiammatoria osservata [41, 42]. Qui, i leucociti si attaccano all’endotelio delle pareti venose e ai lembi valvolari, causando la necrosi e/o l’apoptosi dell’endotelio, dei fibroblasti, delle cellule muscolari lisce e delle cellule parenchimali della parete venosa. Ciò provoca l’indebolimento e la distruzione delle pareti venose e dei lembi valvolari, portando ai cambiamenti venosi osservati nella SD [43, 44]. Un aumento del numero di linfociti T, macrofagi e mastociti è stato osservato anche nelle biopsie cutanee della parte inferiore delle gambe di individui con insufficienza venosa cronica, supportando ulteriormente l’associazione dei mediatori dell’infiammazione con il danno cutaneo [2, 43]. Nella SD, l’ipertensione venosa promuove l’accumulo cellulare di cellule infiammatorie, come i macrofagi, così come lo stravaso di eritrociti nelle aree colpite. Lo stravaso di eritrociti è seguito dalla decomposizione dell’emoglobina, che si traduce in un eccessivo accumulo di ferro che viene immagazzinato nei tessuti colpiti come emosiderina. Un ulteriore accumulo di macrofagi è indotto dall’accumulo di emosiderina ed emoglobina. Tali macrofagi, insieme ad altre cellule, promuovono l’infiammazione e inducono diverse caratteristiche istologiche osservate nella SD, inclusi i cambiamenti spongiosi epidermici e la proliferazione capillare [17].
È stato anche dimostrato che l’espressione della molecola di adesione intercellulare-1 e della molecola di adesione delle cellule vascolari-1 sulle cellule endoteliali microvascolari, e i loro ligandi associati alla funzione linfocitaria dell’antigene-1 e dell’antigene-4 molto tardivo sui leucociti, è sovraregolata nelle prime fasi di insufficienza venosa cronica, compresa SD. Questo processo rimane sovraregolato con il progredire della SD. Ciò faciliterebbe la trasmigrazione dei leucociti nei tessuti vicini. È stato anche scoperto che i cheratinociti basali epidermici esprimono livelli elevati di molecola di adesione intercellulare-1 e molecola di adesione delle cellule vascolari-1 nella SD, promuovendo potenzialmente il danno del tessuto cutaneo attraverso un afflusso perpetuato e sovraregolato di leucociti attivati e portando infine a ulcerazioni cutanee [45].
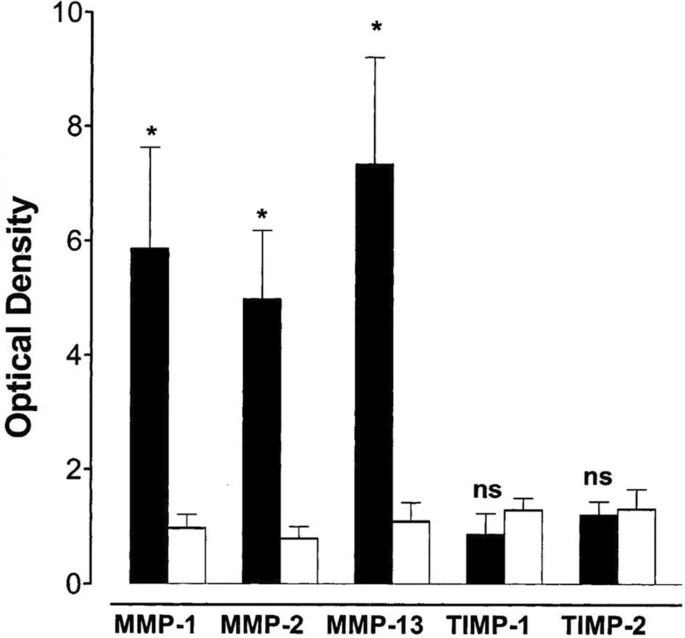
Gli studi hanno anche dimostrato il ruolo delle metalloproteinasi della matrice (MMP) nel rimodellamento della pelle lesionale nella SD attraverso la degradazione delle proteine della matrice extracellulare e la compromissione della guarigione. In uno studio che ha esaminato campioni di pelle di 19 pazienti con SD, sono stati trovati livelli elevati di MMP-1, MMP-2 e MMP-13, con livelli ridotti di inibitore tissutale delle metalloproteinasi (TIMP)-1 e TIMP-2, rispetto a campioni di controllo sani (Fig. 3, 4). Tale sovraespressione e produzione di MMP-1, MMP-2 e MMP-13, senza gli effetti inibitori di TIMP-1 e TIMP-2, può essere il risultato dell’induzione mediata da citochine [46]. L’aumento dell’espressione di MMP e di altre proteinasi da parte della parete del vaso promuove un’ulteriore degradazione della matrice extracellulare vascolare, con conseguente permeabilità vascolare anormale e edema [1]. Inoltre, il rilascio di ferritina e ione ferrico dagli eritrociti stravasati può provocare stress ossidativo e ulteriore attivazione di MMP, promuovendo danni al tessuto cutaneo, formazione di ulcere e ritardando la guarigione [2, 4, 47]. Le MMP così come altre forme di infiammazione possono anche causare iperpigmentazione cutanea nella SD [2].
Si sa molto poco sui meccanismi fisiopatologici del prurito legato alla SD. Il prurito può essere istaminergico o non istaminergico. Il prurito correlato a SD è probabilmente non istaminergico perché gli antistaminici non migliorano il prurito associato a SD. Tale prurito non istaminergico coinvolge vari mediatori, tra cui citochine/chemochine (per es., interleuchina [IL]-31), ammine, neuropeptidi e i loro recettori, proteasi e i loro recettori, canali ionici e cellule immunitarie (per es. e basofili). IL-31 è stato implicato nell’induzione del prurito in diverse malattie, tra cui AD, psoriasi, prurigo nodularis e linfoma cutaneo a cellule T. Un recente studio di Hashimoto et al. ha dimostrato il potenziale coinvolgimento dell’IL-31 cutanea dai macrofagi nell’indurre il prurito associato a SD. La maggior parte delle cellule che esprimono IL-31 nella SD sono macrofagi CD68+. Tali macrofagi CD68+, che coesprimono CD163 (un marcatore di membrana specifico per i macrofagi), sono classificati come macrofagi M2. Il numero di macrofagi IL31+CD68+ era più alto nei pazienti con SD con prurito grave rispetto a SD senza prurito grave. Il numero di macrofagi IL31+CD68+ era positivamente correlato con il numero di cellule della sostanza P+, le cellule dermiche del recettore delle chemochine C-C di tipo 4+ T helper di tipo 2, i basofili e la deposizione dermica di emosiderina e periostina [17].
Trattamento.
Gli obiettivi delle attuali opzioni terapeutiche nei pazienti con SD includono l’affrontare l’impatto clinico dell’insufficienza venosa sottostante, dell’edema e dell’infiammazione (prurito e dolore), il miglioramento delle lesioni cutanee e la guarigione delle ulcere (Tabella 2). Le opzioni iniziali per il trattamento della SD includono esercizio fisico, deambulazione e sollevamento delle gambe, sebbene tali approcci siano generalmente efficaci solo per i casi lievi di SD [1, 2]. La pietra angolare del trattamento per SD rimane la terapia compressiva attraverso bende o calze, utilizzando un’alta pressione di circa 60 mmHg o una pressione mediana di circa 30 mmHg [48], rispettivamente, per ridurre la pressione venosa ambulatoriale e l’ipertensione risultante. Sebbene sia stato dimostrato che la compressione allevia il gonfiore, il dolore e le alterazioni cutanee da stasi nei pazienti con SD, questo approccio spesso fallisce a causa della mancata aderenza o della perdita di elasticità della calza dopo l’uso ripetuto [1, 2, 49,50,51,52]. In effetti, solo il 50-60% circa dei pazienti aderisce alla terapia compressiva, con le bende più difficili da applicare correttamente (rispetto alle calze) senza una guida professionale [2, 50, 53]. Inoltre, la gomma sintetica nelle calze a compressione può causare dermatiti allergiche da contatto degli arti inferiori, con un ulteriore impatto sull’aderenza al trattamento [54]. Possono essere utilizzate anche medicazioni topiche, come lo stivale Unna, che è una benda che contiene ossido di zinco umido. Tali medicazioni fungono da compressioni non elastiche che contengono un trattamento topico per SD. Lo stivale Unna può anche essere combinato con altri trattamenti, compresi i corticosteroidi topici. L’uso dello stivale Unna allevia vari sintomi della SD, tra cui infiammazione cutanea, prurito ed eczema [1]. Uno studio ha rilevato che l’uso dello stivale Unna su un unguento topico è più efficace della sola compressione dello stivale Unna [55].
Sebbene nessun farmaco sia attualmente approvato per il trattamento dei sintomi della SD, vengono utilizzate diverse opzioni topiche per alleviare i sintomi associati alla SD. I trattamenti per la cura della pelle per SD includono detergenti non a base di sapone, preparati barriera e blandi emollienti [2]. Si raccomanda l’idratazione attraverso l’applicazione abbondante di emollienti per affrontare la secchezza cutanea associata alla concomitante xerosi [56]. I corticosteroidi topici ad alta o media potenza possono anche essere usati in modo intermittente per alleviare il prurito, sebbene l’uso prolungato possa portare ad atrofia cutanea ed effetti collaterali sistemici [1, 57]. Anche gli inibitori topici della calcineurina sono un’opzione data la loro efficacia in altre dermatosi sensibili agli steroidi. Sebbene il tacrolimus topico (usato off-label) abbia dimostrato di essere efficace per il trattamento della DS, gli inibitori topici della calcineurina sono associati a una sensazione di bruciore all’applicazione e richiedono l’educazione del paziente a causa di un avviso di scatola per un aumentato rischio di linfoma [57, 58,59]. L’iperpigmentazione cutanea spesso persiste anche se si cura l’insufficienza venosa cronica; sebbene le risposte siano spesso scarse, la luce pulsata intensa non coerente o i trattamenti laser rappresentano un approccio alla rimozione dell’iperpigmentazione [60].
Più trattamenti orali hanno mostrato risultati promettenti nel migliorare alcuni dei sintomi sperimentati dai pazienti con SD. La pentossifillina orale viene spesso utilizzata con o senza terapia compressiva per ridurre il dolore alle gambe e aumentare il tasso di guarigione delle ulcere venose [61]. La pentossifillina è un inibitore dell’aggregazione piastrinica che riduce la viscosità del sangue, migliorando così la microcircolazione. La pentossifillina si è dimostrata efficace per il trattamento delle ulcere venose quando aggiunta alla terapia compressiva [62]. L’edema può essere ridotto attraverso l’uso di farmaci venoattivi, che riducono la permeabilità capillare, aumentano il tono venoso, diminuiscono la viscosità del sangue e migliorano il drenaggio linfatico [2]. L’escina, un estratto di semi di ippocastano che stimola le prostaglandine della serie F, viene utilizzata per migliorare i sintomi dell’insufficienza venosa cronica a breve termine [63]. Un altro farmaco venoattivo, la frazione flavonoidica purificata micronizzata, si è dimostrato più potente di altri farmaci venoattivi nel ridurre l’edema della caviglia [64].
Gli idrossietilrutosidi possono anche essere utilizzati per alleviare i sintomi dell’insufficienza venosa cronica, inclusi dolore, crampi e sensazione di pesantezza alle gambe. Gli idrossietilrutosidi sono una miscela standardizzata di flavonoidi semisintetici derivati dall’idrossilazione della sostanza naturale rutina. I benefici degli idrossietilrutosidi per l’insufficienza venosa cronica possono essere dovuti alla loro capacità di inibire la filtrazione capillare riducendo la permeabilità microvascolare, con conseguente riduzione dell’edema e miglioramento della microcircolazione. Tuttavia, una meta-analisi che ha valutato l’efficacia degli idrossietilrutosidi per l’insufficienza venosa cronica ha riscontrato solo modesti miglioramenti in diversi sintomi associati; tutti gli studi analizzati erano di qualità limitata [65]. Le infezioni batteriche secondarie, se presenti, possono essere trattate con appropriati antibiotici orali [1]. Gli antistaminici sono stati usati nel tentativo di alleviare il prurito, ma le risposte sono state scarse; tali risultati non sono inaspettati perché il prurito associato alla SD non è guidato dalla via dell’istamina, come notato in precedenza [1, 17].
L’edema correlato al calcio-antagonista (CCB) è comune nella pratica clinica ed è dovuto a una diminuzione della resistenza arteriolare, che aumenta la pressione idrostatica nella circolazione precapillare, causando spostamenti di liquidi nel compartimento interstiziale. I farmaci antipertensivi, come l’amlodipina, sono CCB che aumentano la permeabilità capillare [66]. Se usati in monoterapia, tali CCB sono associati a un rischio sostanziale di sviluppare edema periferico, che è la ragione più comune per la loro interruzione [67]. L’interruzione del CCB o il passaggio a una terapia antipertensiva alternativa, come gli inibitori dell’enzima di conversione dell’angiotensina o i bloccanti del recettore dell’angiotensina, può ridurre l’edema periferico associato [66].
Sono disponibili anche opzioni interventistiche che mirano a trattare il reflusso venoso sottostante. Le classiche tecniche chirurgiche a cielo aperto sono state sostituite da procedure minimamente invasive, come la scleroterapia con schiuma guidata da ultrasuoni, la termoablazione endovenosa e la flebectomia ambulatoriale. Rispetto alle tecniche convenzionali, le procedure minimamente invasive sono meno dolorose, sono associate a un minor numero di complicanze, sono più convenienti e hanno tempi di recupero più rapidi [2, 38, 68,69,70].
Dato il ruolo centrale nella patogenesi della DS, l’infiammazione rappresenta un focus logico per lo sviluppo di nuove opzioni terapeutiche. La fosfodiesterasi 4 è un enzima non recettore intracellulare che modula l’infiammazione e i pazienti con malattie infiammatorie (AD, lupus eritematoso discoide e psoriasi) mostrano espressioni elevate di fosfodiesterasi 4 rispetto agli individui sani [57, 71]. Inoltre, il targeting della fosfodiesterasi 4 è stato verificato come una strategia terapeutica efficace per diverse condizioni infiammatorie, tra cui psoriasi e AD [71]. Il crisaborolo, un inibitore topico della fosfodiesterasi 4 approvato per il trattamento dell’AD in più paesi, è stato sottoposto a valutazione nello studio di fase 2 completato (NCT04091087) negli adulti con SD [72, 73]. Il crisaborolo viene rapidamente metabolizzato in metaboliti inattivi che non hanno alcun effetto sul rilascio di citochine o sull’attività della fosfodiesterasi 4, limitando l’esposizione sistemica e riducendo il rischio di effetti avversi. Un inibitore topico della fosfodiesterasi potrebbe portare all’inibizione mirata dell’infiammazione osservata nelle malattie della pelle evitando effetti collaterali indesiderati [57].
Nel caso delle ulcere venose, le opzioni terapeutiche comprendono la gestione, le modalità meccaniche, la terapia delle ferite, i farmaci e/o la chirurgia. Le opzioni di gestione includono l’uso della terapia compressiva, che è la modalità di trattamento standard per il trattamento a lungo termine delle ulcere venose, o l’uso di medicazioni. La terapia compressiva riduce il dolore e l’edema, migliora il reflusso venoso, migliora la guarigione dell’ulcera e previene la recidiva dell’ulcera. Si possono usare anche calze o bende. L’uso di vari strati è più efficace rispetto a strati singoli, con i sistemi elastici che sono più efficaci di quelli non elastici [74]. Nei pazienti con ulcere guarite, le calze compressive aiutano a ridurre di circa la metà il rischio di recidiva dell’ulcera [75]. Si raccomandano medicazioni topiche per favorire la guarigione della ferita in ambiente umido e coprire le ulcere, sebbene nessuna medicazione abbia dimostrato di essere superiore [62, 74]. I farmaci più comunemente usati sono gli analgesici orali (come i farmaci antinfiammatori, il paracetamolo e il metamizolo) e le creme anestetiche topiche (come la prilocaina e la lidocaina). I farmaci topici, che includono pentossifillina e flebotonica, possono essere applicati come monoterapie o in combinazione con la terapia compressiva [37, 74, 76]. Gli antibiotici e gli antisettici possono essere utilizzati per rallentare la colonizzazione batterica nelle ulcere venose, migliorando così la guarigione delle ferite; tuttavia, una revisione degli antibiotici e degli antisettici sistemici e topici per il trattamento dell’ulcera venosa non ha trovato alcuna correlazione tra l’uso routinario di antibiotici orali e la guarigione dell’ulcera [62, 77]. Le opzioni chirurgiche, che includono l’ablazione endovenosa e l’innesto cutaneo, possono anche essere utilizzate per promuovere la guarigione e prevenire la recidiva dell’ulcera [74]. Un ampio studio di revisione che ha valutato 832 pazienti con insufficienza venosa cronica avanzata (punteggi clinici CEAP di 4-6) ha rilevato che l’intervento chirurgico ha portato a un tasso di guarigione dell’ulcera del 92%, con tassi di recidiva fino al 4% [78]. Le opzioni chirurgiche sono state studiate anche rispetto alla terapia compressiva non chirurgica, in cui la chirurgia ha ridotto la recidiva dell’ulcera rispetto al trattamento non chirurgico dopo 4 anni (31% vs 56%, rispettivamente) [79]. Nei pazienti con ulcere ricorrenti, l’aggiunta della chirurgia superficiale ablativa al trattamento standard può essere un’opzione [79]. Oltre all’aggiunta della chirurgia per le ulcere ricorrenti, il trattamento standard con la terapia compressiva rimane il trattamento di prima scelta per i pazienti con ulcere venose [80].
Conclusioni.
La DS rappresenta la manifestazione cutanea dell’ipertensione venosa causata dal reflusso venoso e si verifica più comunemente nelle estremità inferiori degli individui anziani. I cambiamenti cutanei associati alla SD sono guidati dall’infiammazione. La tipica presentazione clinica comprende chiazze e placche eritematose ed eczematose. Il prurito è uno dei sintomi più fastidiosi e spesso porta a grattarsi che può aggravare le ferite e aumentare il rischio di infezione della pelle. La DS può anche progredire verso ulcerazioni venose croniche con stillicidio ed eritema. Di conseguenza, la diagnosi e il trattamento tempestivi sono essenziali per prevenire gravi complicanze. Tuttavia, la diagnosi è difficile a causa della somiglianza della SD con altre condizioni della pelle. La pietra angolare del trattamento comprende la terapia compressiva per migliorare il dolore e il gonfiore, insieme a trattamenti topici per alleviare i cambiamenti cutanei secondari e i segni e i sintomi associati. Nessun trattamento è attualmente approvato per alleviare i sintomi associati alla DS; sono quindi necessari nuovi approcci terapeutici che mirano all’infiammazione nella SD.
Note.
-
Rzepecki AK, Blasiak R. Stasis dermatitis: differentiation from other common causes of lower leg inflammation and management strategies. Curr Geriat Rep. 2018;7(4):222–7.
-
Sundaresan S, Migden MR, Silapunt S. Stasis dermatitis: pathophysiology, evaluation, and management. Am J Clin Dermatol. 2017;18(3):383–90.
-
Theodosat A. Skin diseases of the lower extremities in the elderly. Dermatol Clin. 2004;22(1):13–21.
-
Bergan JJ, Schmid-Schönbein GW, Smith PDC, Nicolaides AN, Boisseau MR, Eklof B. Chronic venous disease. N Engl J Med. 2006;355(5):488–98.
-
Labropoulos N. Hemodynamic changes according to the CEAP classification. Phlebolymphol. 2003;40(4):130–6.
-
Beebe-Dimmer JL, Pfeifer JR, Engle JS, Schottenfeld D. The epidemiology of chronic venous insufficiency and varicose veins. Ann Epidemiol. 2005;15(3):175–84.
-
Bawakid KO, Al-Raddadi RM, Sabban SS, Alturky KA, Mohamed MS. Prevalence of chronic venous insufficiency in the Saudi adult population. Saudi Med J. 2005;26(2):225–9.
-
Evans C, Fowkes F, Ruckley C, Lee A. Prevalence of varicose veins and chronic venous insufficiency in men and women in the general population: Edinburgh Vein Study. J Epidemiol Comm Heal. 1999;53(3):149–53.
-
Chiesa R, Marone EM, Limoni C, Volonté M, Schaefer E, Petrini O. Chronic venous insufficiency in Italy: the 24-cities cohort study. Eur J Vascul Endovascul Surg. 2005;30(4):422–9.
-
White JV, Ryjewski C. Chronic venous insufficiency. Perspect Vascul Surg Endovascul Therap. 2005;17(4):319–27.
-
Nazarko L. Diagnosis and treatment of venous eczema. Br J Community Nurs. 2009;14(5):188–94.
-
Maffei FHDA, Magaldi C, Pinho S, Lastoria S, Pinho W, Yoshida W, et al. Varicose veins and chronic venous insufficiency in Brazil: prevalence among 1755 inhabitants of a country town. Int J Epidemiol. 1986;15(2):210–7.
-
Yalçin B, Tamer E, Toy GG, Oztaş P, Hayran M, Alli N. The prevalence of skin diseases in the elderly: analysis of 4099 geriatric patients. Int J Dermatol. 2006;45(6):672–6.
-
Tracz E, Zamojska E, Modrzejewski A, Zaborski D, Grzesiak W. Quality of life in patients with venous stasis ulcers and others with advanced venous insufficiency. Holis Nurs Pract. 2015;29(2):96–102.
-
Nelson EA, Harper DR, Prescott RJ, Gibson B, Brown D, Ruckley CV. Prevention of recurrence of venous ulceration: randomized controlled trial of class 2 and class 3 elastic compression. J Vasc Surg. 2006;44(4):803–8.
-
Lurie F, Passman M, Meisner M, Dalsing M, Masuda E, Welch H, et al. The 2020 update of the CEAP classification system and reporting standards. J Vascul Surg Ven Lymph Disord. 2020;8(3):342–52.
-
Hashimoto T, Kursewicz CD, Fayne RA, Nanda S, Shah SM, Nattkemper L, et al. Mechanisms of itch in stasis dermatitis: significant role of IL-31 from macrophages. J Invest Dermatol. 2020;140(4):850–9.
-
Morris AD. Cellulitis and erysipelas. BMJ Clin Evid. 2008;2008:1708.
-
Institute for Quality and Efficiency in Health Care (IQWiG). Erysipelas and cellulitis: Overview. 2015 Jun 03 [cited 2022 Nov 11]; https://www.ncbi.nlm.nih.gov/books/NBK303996/
-
Palmer B, Xia Y, Cho S, Lewis FS. Acroangiodermatitis secondary to chronic venous insufficiency. Cutis. 2010;86(5):239–40.
-
Kaplan RM, Criqui MH, Denenberg JO, Bergan J, Fronek A. Quality of life in patients with chronic venous disease: San Diego population study. J Vasc Surg. 2003;37(5):1047–53.
-
Kahn SR, M’lan CE, Lamping DL, Kurz X, Bérard A, Abenhaim LA, et al. Relationship between clinical classification of chronic venous disease and patient-reported quality of life: results from an international cohort study. J Vasc Surg. 2004;39(4):823–8.
-
Valdes-Rodriguez R, Mollanazar NK, González-Muro J, Nattkemper L, Torres-Alvarez B, López-Esqueda FJ, et al. Itch prevalence and characteristics in a Hispanic geriatric population: a comprehensive study using a standardized itch questionnaire. Acta Derm Venereol. 2015;95(4).
-
Paul JC, Pieper B, Templin TN. Itch: association with chronic venous disease, pain, and quality of life. J Wound Ostomy Continence Nurs. 2011;38(1):46–54.
-
McGuckin M, Waterman R, Brooks J, Cherry G, Porten L, Hurley S, et al. Validation of venous leg ulcer guidelines in the United States and United Kingdom. Am J Surg. 2002;183(2):132–7.
-
Spiridon M, Corduneanu D. Chronic venous insufficiency: a frequently underdiagnosed and undertreated pathology. Maedica (Bucur). 2017;12(1):59–61.
-
Sung CT, Taguines PR, Jacob SE. Stasis dermatitis. J Dermatol Nur Assoc. 2019;11(3):134–6.
-
Fiebig A, Krusche P, Wolf A, Krawczak M, Timm B, Nikolaus S, et al. Heritability of chronic venous disease. Hum Gen. 2010;127(6):669–74.
-
Suehiro K, Morikage N, Murakami M, Yamashita O, Ueda K, Samura M, et al. A study of leg edema in immobile patients. Circ J. 2014;78(7):1733–9.
-
Zygmunt JA. Duplex ultrasound for chronic venous insufficiency. J Invasive Cardiol. 2014;26(11):E149–55.
-
Keller EC, Tomecki KJ, Alraies MC. Distinguishing cellulitis from its mimics. Cleve Clin J Med. 2012;79(8):547–52.
-
Strazzula L, Cotliar J, Fox LP, Hughey L, Shinkai K, Gee SN, et al. Inpatient dermatology consultation aids diagnosis of cellulitis among hospitalized patients: a multi-institutional analysis. J Amer Acad Dermatol. 2015;73(1):70–5.
-
Renner R, Wollina U. Contact sensitization in patients with leg ulcers and/or leg eczema: comparison between centers. Int J Low Extrem Wounds. 2002;1(4):251–5.
-
Id reaction (autoeczematization): background, pathophysiology, epidemiology 2018 Mar 23 [cited 2022 Jan 26]; https://emedicine.medscape.com/article/1049760-overview#a6
-
Sardana K, Sarkar R, Sehgal VN. Pigmented purpuric dermatoses: an overview. Int J Dermatol. 2004;43(7):482–8.
-
Naik PP, Farrukh SN. Clinical significance of diabetic dermatopathy. Diabetes Metab Syndr Obes. 2020;13:4823–7.
-
Davies AH. The seriousness of chronic venous disease: a review of real-world evidence. Adv Ther. 2019;36(Suppl 1):5S-12S.
-
Gloviczki P, Comerota AJ, Dalsing MC, Eklof BG, Gillespie DL, Gloviczki ML, et al. The care of patients with varicose veins and associated chronic venous diseases: clinical practice guidelines of the Society for Vascular Surgery and the American Venous Forum. J Vasc Surg. 2011;53(Suppl 5):2S-48S.
-
Payne SP, London NJ, Newland CJ, Thrush AJ, Barrie WW, Bell PR. Ambulatory venous pressure: correlation with skin condition and role in identifying surgically correctible disease. Eur J Vasc Endovasc Surg. 1996;11(2):195–200.
-
Sippel K, Mayer D, Ballmer B, Dragieva G, Läuchli S, French L, et al. Evidence that venous hypertension causes stasis dermatitis. Phlebology. 2011;26(8):361–5.
-
Thomas PR, Nash GB, Dormandy JA. White cell accumulation in dependent legs of patients with venous hypertension: a possible mechanism for trophic changes in the skin. Br Med J (Clin Res Ed). 1988;296(6638):1693–5.
-
Moyses C, Cederholm-Williams SA, Michel CC. Haemoconcentration and accumulation of white cells in the feet during venous stasis. Int J Microcirc Clin Exp. 1987;5(4):311–20.
-
Wilkinson L, Bunker C, Edwards J, Scurr J, Smith PC. Leukocytes: their role in the etiopathogenesis of skin damage in venous disease. J Vasc Surg. 1993;17(4):669–75.
-
Takase S, Pascarella L, Lerond L, Bergan JJ, Schmid-Schönbein GW. Venous hypertension, inflammation and valve remodeling. Eur J Vasc Endovasc Surg. 2004;28(5):484–93.
-
Peschen M, Lahaye T, Hennig B, Weyl A, Simon JC, Vanscheidt W. Expression of the adhesion molecules ICAM-1, VCAM-1, LFA-1 and VLA-4 in the skin is modulated in progressing stages of chronic venous insufficiency. Acta Dermat Venereol. 1999;79(1):27–32.
-
Herouy Y, Mellios P, Bandemir E, Dichmann S, Nockowski P, Schöpf E, et al. Inflammation in stasis dermatitis upregulates MMP-1, MMP-2 and MMP-13 expression. J Dermatol Sci. 2001;25(3):198–205.
-
Wenk J, Foitzik A, Achterberg V, Sabiwalsky A, Dissemond J, Meewes C, et al. Selective pick-up of increased iron by deferoxamine-coupled cellulose abrogates the iron-driven induction of matrix-degrading metalloproteinase 1 and lipid peroxidation in human dermal fibroblasts in vitro: a new dressing concept. J Invest Dermatol. 2001;116(6):833–9.
-
Mosti G, Picerni P, Partsch H. Compression stockings with moderate pressure are able to reduce chronic leg oedema. Phlebology. 2012;27(6):289–96.
-
Cullum N, Nelson E, Fletcher A, Sheldon T. Compression for venous leg ulcers. Cochr Data Syst Rev. 2001;2:CD0000265.
-
Sippel K, Seifert B, Hafner J. Donning devices (foot slips and frames) enable elderly people with severe chronic venous insufficiency to put on compression stockings. Eur J Vasc Endovasc Surg. 2015;49(2):221–9.
-
Stolk R, Wegen Van Der‐Franken C, Neumann H. A method for measuring the dynamic behavior of medical compression hosiery during walking. Dermatol Surg. 2004;30(5):729–36.
-
Raju S, Hollis K, Neglen P. Use of compression stockings in chronic venous disease: patient compliance and efficacy. Annals Vasc Surg. 2007;21(6):790–5.
-
Suehiro K, Morikage N, Yamashita O, Harada T, Ueda K, Samura M, et al. Adherence to and efficacy of different compression methods for treating chronic venous insufficiency in the elderly. Phlebolog. 2016;31(10):723–8.
-
Mizuno J, In-Nami H. Allergic contact dermatitis to synthetic rubber, neoprene in compression stockings. Masui Jpn J Anesthesiol. 2011;60(1):104–6.
-
Kucharzewski M, Kózka M, Urbanek T. Topical treatment of nonhealing venous leg ulcer with propolis ointment. Evid-Bas Complem Alt Med. 2013;2013.
-
Kirkup ME. Xerosis and stasis dermatitis. Preventive Dermatology. London: Springer; 2011. p. 71–79.
-
Paller AS, Tom WL, Lebwohl MG, Blumenthal RL, Boguniewicz M, Call RS, et al. Efficacy and safety of crisaborole ointment, a novel, nonsteroidal phosphodiesterase 4 (PDE4) inhibitor for the topical treatment of atopic dermatitis (AD) in children and adults. J Am Acad Dermatol. 2016;75(3):494–503.
-
Dissemond J, Knab J, Lehnen M, Franckson T, Goos M. Successful treatment of stasis dermatitis with topical tacrolimus. Vasa. 2004;33(4):260–2.
-
Eichenfield LF, Tom WL, Berger TG, Krol A, Paller AS, Schwarzenberger K, et al. Guidelines of care for the management of atopic dermatitis: section 2. Management and treatment of atopic dermatitis with topical therapies. J Am Acad Dermatol. 2014;71(1):116–32.
-
Tafazzoli A, Rostan EF, Goldman MP. Q-switched ruby laser treatment for postsclerotherapy hyperpigmentation. Dermatol Surg. 2000;26(7):653–6.
-
Parsa H, Zangivand AA, Hajimaghsoudi L. The effect of pentoxifylline on chronic venous ulcers. Wounds. 2012;24(7):190–4.
-
Collins L, Seraj S. Diagnosis and treatment of venous ulcers. Am Fam Physician. 2010;81(8):989–96.
-
Pittler MH, Ernst E. Horse chestnut seed extract for chronic venous insufficiency. Cochr Data System Rev. 2012;11:CD003230.
-
Allaert F. Meta-analysis of the impact of the principal venoactive drugs agents on malleolar venous edema. Int Angiol. 2012;31(4):310–5.
-
Aziz Z, Tang W, Chong N, Tho L. A systematic review of the efficacy and tolerability of hydroxyethylrutosides for improvement of the signs and symptoms of chronic venous insufficiency. J Clin Pharm Therap. 2015;40(2):177–85.
-
Sica DA. Calcium channel blocker-related peripheral edema: can it be resolved? J Clin Hyperten. 2003;5(4):291–5.
-
Khadka S, Joshi R, Shrestha DB, Shah D, Bhandari N, Maharjan M, et al. Amlodipine-induced pedal edema and its relation to other variables in patients at a tertiary level hospital of Kathmandu, Nepal. J Pharm Tech. 2019;35(2):51–5.
-
Hamdan A. Management of varicose veins and venous insufficiency. JAMA. 2012;308(24):2612–21.
-
Chapman-Smith P, Browne A. Prospective five-year study of ultrasound-guided foam sclerotherapy in the treatment of great saphenous vein reflux. Phlebolog. 2009;24(4):183–8.
-
Almeida JI, Raines JK. Ambulatory phlebectomy in the office. Perspect Vasc Surg Endovasc Therap. 2008;20(4):348–55.
-
Schick MA, Schlegel N. Clinical implication of phosphodiesterase-4-inhibition. Int J Mol Sci. 2022;23(3):1209.
-
Schlessinger J, Shepard JS, Gower R, Su JC, Lynde C, Cha A, et al. Safety, effectiveness, and pharmacokinetics of crisaborole in infants aged 3 to < 24 months with mild-to-moderate atopic dermatitis: a phase IV open-label study (CrisADe CARE 1). Am J Clin Dermatol. 2020;21(2):275–84.
-
ClinicalTrials.gov. Identifier NCT04091087 Study Evaluating Efficacy and Safety of Crisaborole in Adults With Stasis Dermatitis. 2019 Sept 16 [cited 2022 Feb 01]; https://clinicaltrials.gov/ct2/show/NCT04091087
-
Millan SB, Gan R, Townsend PE. Venous ulcers: diagnosis and treatment. Am Fam Physic. 2019;100(5):298–305.
-
Health Quality Ontario. Compression stockings for the prevention of venous leg ulcer recurrence: a health technology assessment. Ontario Health Technol Assess Ser. 2019;19(2):1–86.
-
Imbernon-Moya A, Ortiz-de Frutos F, Sanjuan-Alvarez M, Portero-Sanchez I, Merinero-Palomares R, Alcazar V. Treatment of chronic venous ulcers with topical sevoflurane: a retrospective clinical study. Br J Anaesth. 2017;119(4):846–7.
-
O’Meara S, Al-Kurdi D, Ologun Y, Ovington LG, Martyn-St James M, Richardson R. Antibiotics and antiseptics for venous leg ulcers. Cochr Data System Rev. 2014;10(1):CD003557.
-
Tawes RL, Barron ML, Coello AA, Joyce DH, Kolvenbach R. Optimal therapy for advanced chronic venous insufficiency. J Vasc Surg. 2003;37(3):545–51.
-
Gohel MS, Barwell JR, Taylor M, Chant T, Foy C, Earnshaw JJ, et al. Long term results of compression therapy alone versus compression plus surgery in chronic venous ulceration (ESCHAR): randomised controlled trial. BMJ. 2007;335:83.
Rai R. Standard guidelines for management of venous leg ulcer. Ind Dermatol Onlin J. 2014;5(3):408–11.
Ringraziamenti
Il supporto editoriale/medico alla scrittura sotto la guida degli autori è stato fornito da Mark Bloom, Ph.D. (ApotheCom, Yardley, PA, USA) e David Gibson, Ph.D., CMPP (ApotheCom, San Francisco, CA, USA), ed è stato finanziato da Pfizer Inc., New York, NY, USA, in conformità con Good Linee guida sulla prassi di pubblicazione (GPP 2022) (Ann Intern Med. 2022; 10.7326/M22-1460).



