Linee Guida sul Vaccino anti-Covid e sulla gestione dei Pazienti a rischio allergie ed eventi avversi realizzate dall’AAIITO e dalla SIAAIC.
Le Linee Guida che presentiamo sono state realizzate in partnership dall’Associazione Allergologi Immunologi Italiani Territoriali ed Ospedalieri (AAIITO) e dalla Società Italiana di Allergologia Asma Immunologia Clinica (SIAAIC). Ecco come comportarsi di fronte ad un evento allergico successivo all’immunizzazione con vaccino anti-Covid.
Il successo dell’attuale campagna di vaccinazione per il COVID-19 dipenderà non solo dalla possibilità di garantire un’ampia distribuzione di vaccini efficaci, ma anche dalla adesione della popolazione alla vaccinazione stessa.
In generale le reazioni anafilattiche a vaccini sono rare, pari a circa 1,31 casi per milione di dosi.
Purtroppo, le reazioni anafilattiche segnalate con il vaccino COVID- 19, per quanto raramente osservate nelle varie fasi della sperimentazione e nelle prime fasi delle campagne vaccinali, sembrano essere più frequenti, ed hanno destato preoccupazione nella popolazione.
A campagna vaccinale iniziata negli Usa arrivano i primi dati concreti sulle reazioni anafilattiche ai vaccini contro COVID-19 di Pfizer – BioNTech e Moderna. Sono 21 i casi su un totale di 1,9 milioni di dosi somministrate.
Il tasso di reazioni anafilattiche quindi è di 11,1 casi di per un milione di dosi somministrate, più alto dell’1,3 casi per milione che si ha con il vaccino antinfluenzale, ma che comunque, come sottolineato anche dal Center for Diseases Control (CDC), rimane un’evenienza rara.
L’età media delle persone che hanno avuto queste reazioni è stata di 40 anni e i sintomi sono comparsi nel giro di 13-15 minuti. Sarà pertanto importante monitorare la campagna vaccinale, anche in relazione alla somministrazione della seconda dose del vaccino.
La diffidenza nei confronti dei vaccini è strettamente legata alla loro sicurezza; pertanto, oltre alle verifiche corrette, imparziali e basate sull’evidenza affrontate e risolte dall’AIFA, sarà necessario affrontare tutti i possibili problemi che possono insorgere durante la somministrazione dei vaccini, comprese le reazioni allergiche, che possono essere estremamente gravi mettendo a rischio la vita dei pazienti.
E’ stato correttamente deciso dalle autorità sanitarie di trattenere i pazienti per almeno 15 minuti dopo la vaccinazione anche per poter prontamente affrontare le emergenze allergologiche che dovessero presentarsi.
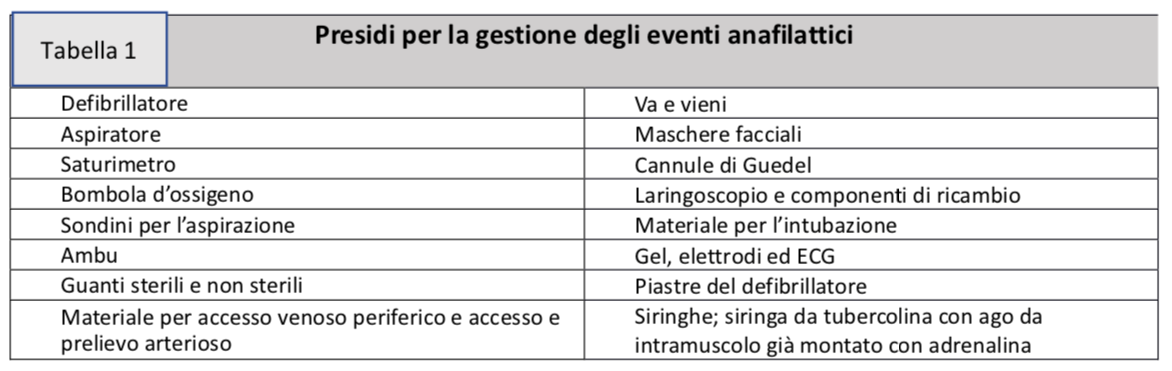
Nell’ambiente dedicato alla vaccinazione dovrebbero pertanto essere disponibili tutti i presidi e i farmaci necessari (tabella 1-2) e sarà ugualmente indispensabile garantire una formazione al personale infermieristico e medico addetto al riconoscimento immediato ed alla gestione di tali emergenze.

La disponibilità di autoiniettori di adrenalina nelle sedi di vaccinazione potrebbe snellire le procedure terapeutiche di urgenza; sarebbe inoltre utile consigliare ai pazienti che la possiedono di portare con sé il proprio autoiniettore.
Devono in particolare essere prontamente riconosciuti e trattati segni e sintomi di anafilassi, anche servendosi di tutorials.
Ricordiamo che i 3 primi momenti “cardine” del trattamento sono:
- posizione supina del paziente;
- adrenalina per via intramuscolare profonda nel muscolo vasto laterale della coscia;
- accesso venoso con infusione di cristalloidi.
Per fornire rassicurazione e supporto durante la campagna di vaccinazione, gli allergologi saranno disponibili ad offrire una guida chiara ai pazienti sulla base delle migliori informazioni disponibili ed in conformità con le raccomandazioni delle agenzie regolatorie.
Nel presente documento viene proposta una stratificazione del rischio allergologico per i soggetti con storia di pregressa reazione allergica per affrontare in sicurezza la prima somministrazione di vaccino per COVID-19 e per quelli che sviluppano una reazione alla loro prima dose di vaccino per COVID-19.
È necessario fare alcune considerazioni che sono alla base del presente documento:
a) non è corretto escludere “tout court” dalla vaccinazione i soggetti allergici, come proposto da alcune agenzie europee;
b) pazienti con reazioni anafilattiche severe (con interessamento respiratorio e/o cardiocircolatorio) da altre sostanze/farmaci o affetti da particolari malattie (mastocitosi, asma non controllato (tabella 3) possono eseguire la vaccinazione, ma necessitano di una gestione più specifica ed individualizzata (ad esempio osservazione prolungata, premedicazione o stabilizzazione della malattia di base);
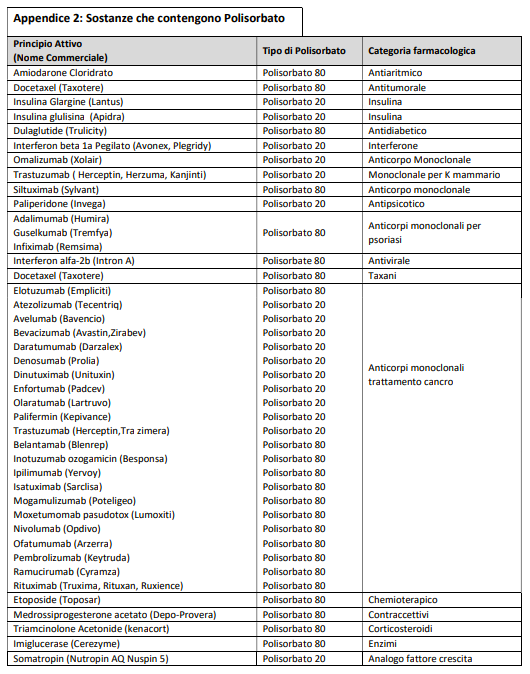
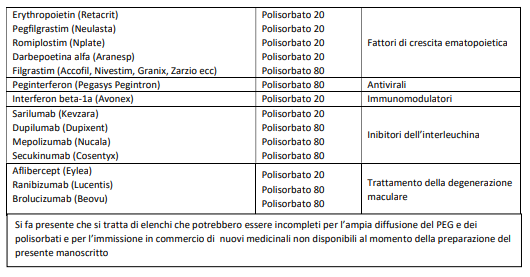
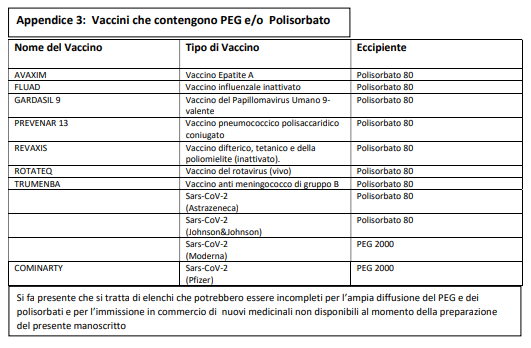
c) i costituenti dei vaccini per COVID-19 ritenuti attualmente sensibilizzanti sono presenti anche in altri medicinali disponibili in commercio (appendice 1-2-3), per cui si rende necessaria una conoscenza specifica di tale problematica, propria dell’allergologo;
d) i pazienti ad alto rischio di reazione anafilattica severa debbono essere vaccinati in ambiente ospedaliero con facile accesso alla sala di rianimazione e con disponibilità immediata dei presidi per affrontare emergenze anafilattiche gravi;
e) il dosaggio della triptasi sierica dopo l’evento acuto (vale a dire entro 2 ore dall’inizio della reazione) è indispensabile per una puntuale caratterizzazione degli eventi anafilattici che dovessero avvenire in corso di vaccinazione.
Il suggerimento delle Società Scientifiche è di sottoporre ai pazienti un questionario allergologico più completo di quello proposto attualmente, prima di effettuare la vaccinazione.
Consapevoli della necessità di procedere rapidamente con la vaccinazione e di non sprecare gli spazi temporali dedicati, suggeriamo di inviare il questionario in anticipo rispetto alla seduta vaccinale.
E’ necessario in particolare verificare se il paziente ha sofferto di anafilassi severa (coinvolgimento del sistema cardiovascolare e/o respiratorio) da qualsiasi causa o da causa non nota, se soffre di asma non controllato, se ha diagnosi di mastocitosi, se ha avuto reazioni allergiche a precedenti vaccini o a glicole polietilenico (PEG) e polisorbati.
I pazienti con almeno una di queste condizioni dovrebbero essere preventivamente inviati a visita allergologica (deve essere previsto un accesso preferenziale e programmabile alla visita specialistica) per effettuare una diagnostica specifica che permetta di stratificare il rischio (figura 1).
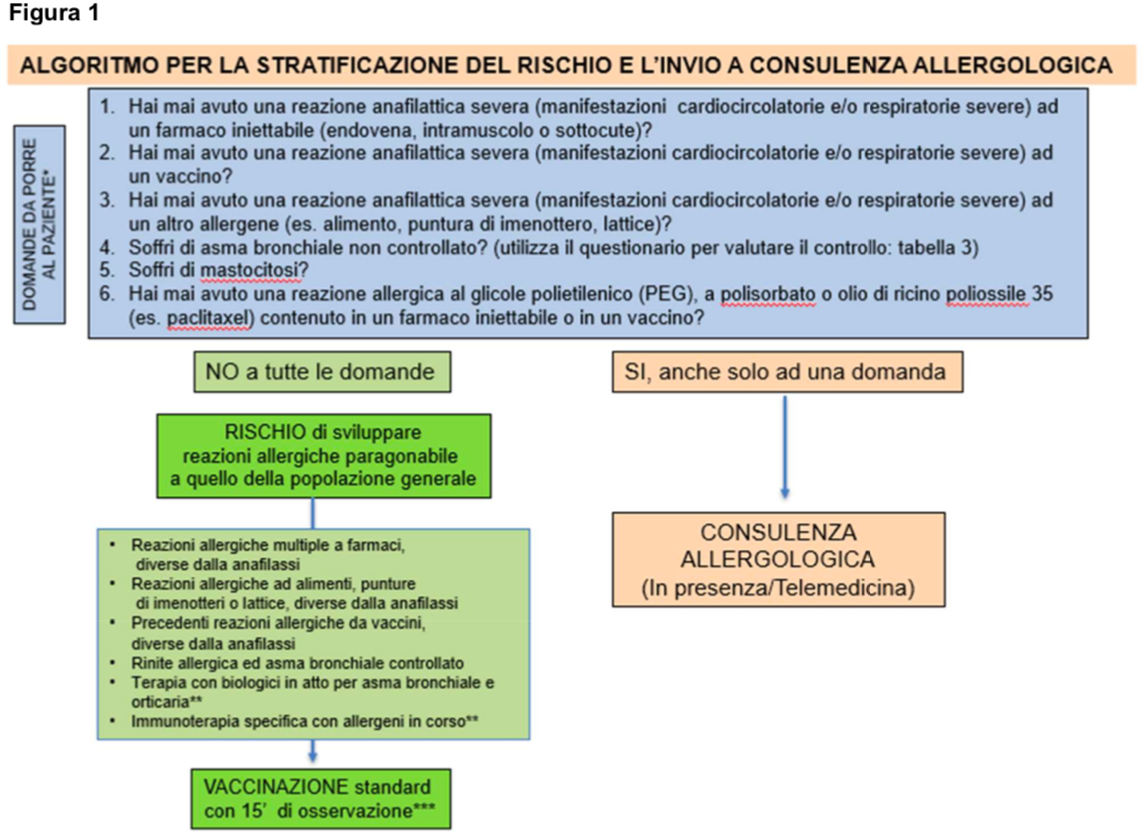
La figura 1 quindi differenzia i soggetti che hanno un rischio di sviluppare reazioni allergiche a seguito della somministrazione di vaccino per COVID-19 del tutto paragonabile alla popolazione generale rispetto a quelli che invece possono avere necessità di una consulenza allergologica (in presenza o tramite telemedicina) sulla base della risposta positiva ad almeno una delle 6 domande poste preliminarmente al paziente.
Pertanto, la consulenza allergologica quindi è necessaria per consegnare un referto di idoneità o meno alla vaccinazione (figura 2) suddividendo quindi i pazienti in:
- a basso-medio rischio;
- ad alto rischio.
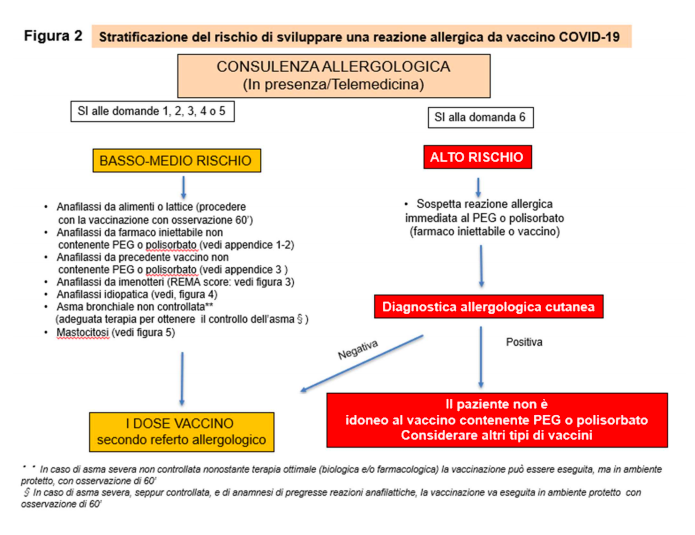
1. VALUTAZIONE DELLE SITUAZIONI A BASSO-MEDIO RISCHIO 1.ANAFILASSI CON COMPROMISSIONE CARDIOCIRCOLATORIA E/O RESPIRATORIA SEVERA DA ALIMENTI O LATTICE.
Si procede alla vaccinazione come da procedura standard (in ambiente vaccinale normale) con osservazione prolungata di 60’ e nei pazienti affetti da asma grave in ambiente controllato. In particolare si fa presente che il tappo del flacone del vaccino per COVID19 Pfizer-BioNTech contiene gomma bromobutilica sintetica. Si ritiene in ogni caso necessario suggerire l’utilizzo di materiale latex-free (siringhe) in ambiente latex-safe.
2. ANAFILASSI CON COMPROMISSIONE CARDIOCIRCOLATORIA E/O RESPIRATORIA SEVERA DA FARMACO INIETTABILE NON CONTENENTE PEG O POLISORBATO.
La vaccinazione può essere eseguita come da procedura standard (in ambiente vaccinale normale) con osservazione prolungata di 60’ e nei pazienti affetti da asma grave in ambiente controllato. Le appendici 1 e 2 riportano elenchi, anche se necessariamente incompleti, di farmaci che contengono PEG e polisorbati, per facilitare l’approfondimento anamnestico dello specialista allergologo.
3. ANAFILASSI CON COMPROMISSIONE CARDIOCIRCOLATORIA E/O RESPIRATORIA SEVERA DA PRECEDENTE VACCINO NON CONTENENTE PEG O POLISORBATO.
La vaccinazione può essere eseguita come da procedura standard (in ambiente vaccinale normale) con osservazione prolungata di 60’ e nei pazienti affetti da asma grave in ambiente controllato. L’appendice 3 riporta l’elenco di vaccini che contengono PEG e polisorbati, per facilitare l’approfondimento anamnestico dello specialista allergologo.
4. ANAFILASSI CON COMPROMISSIONE CARDIOCIRCOLATORIA E/O RESPIRATORIA SEVERA DA IMENOTTERI.
Le reazioni allergiche anche gravi da punture di imenotteri non costituiscono una controindicazione al vaccino, trattandosi di anafilassi la vaccinazione può essere eseguita come da procedura standard (in ambiente vaccinale normale) con osservazione prolungata di 60’ e nei pazienti affetti da asma grave in ambiente controllato.
Se il paziente è in immunoterapia specifica per veleni (VIT) può fare la vaccinazione in ambiente standard con l‘avvertenza di somministrare la vaccinazione a distanza di almeno 48-72h dalla VIT, in modo da poter distinguere con chiarezza gli effetti collaterali attribuibili alla vaccinazione da quelli dovuti alla VIT.
Dal momento che esiste un’associazione preferenziale tra reazioni anafilattiche gravi da allergia al veleno di imenotteri e mastocitosi sistemica indolente senza lesioni cutanee , è importante nei soggetti che abbiano presentato una reazione anafilattica severa escludere una possibile presenza di malattia clonale dei mastociti.
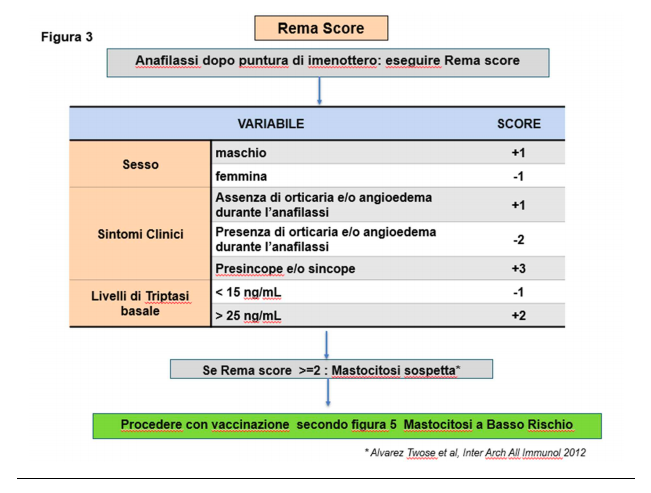
Un utile e veloce strumento che ha mostrato un’elevata sensibilità (91%) e specificità (75%) per lo screening dei pazienti con sospetta mastocitosi con allergia al veleno di imenotteri ma senza lesioni cutanee tipiche è il REMA score (figura 3), il quale identifica quattro elementi clinici (sesso maschile, episodi presincopali e / o sincopali, assenza di orticaria/angioedema e triptasi sierica> 25 ng/mL) come fattori predittivi indipendenti di malattia clonale dei mastociti.
Se il REMA score dà un punteggio ≥ 2 si sospetta una mastocitosi e quindi per la vaccinazione per COVID-19 si applicano i suggerimenti relativi alla diagnosi confermata di mastocitosi.
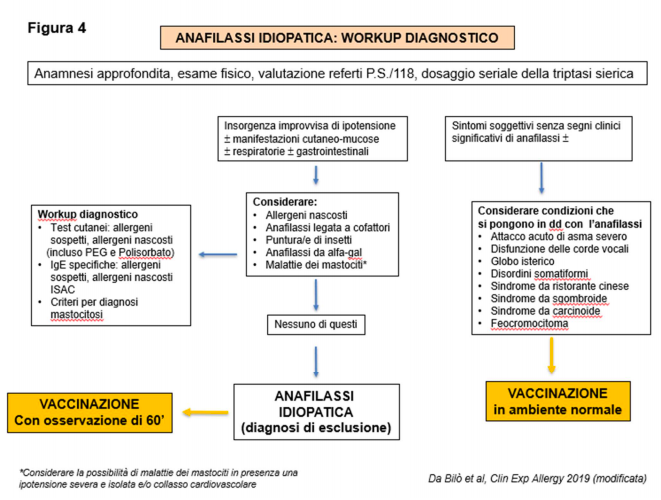
5. ANAFILASSI IDIOPATICA.
L’anafilassi idiopatica (AI) o anafilassi spontanea è una diagnosi di esclusione, qualora non sia stato possibile identificare alcuna causa.
La frequenza dell’AI è estremamente variabile a seconda degli studi, ma sembra essersi ridotta negli ultimi anni, soprattutto laddove la diagnosi viene eseguita in centri specializzati, come riportato dal Registro Europeo sulle reazioni allergiche gravi.
Infatti l’identificazione di allergeni nascosti e di cause rare di anafilassi e il sospetto di malattie di mastociti hanno di fatto circoscritto la diagnosi di AI. 9 Un work-up diagnostico viene proposto nella figura 4. Si sottolinea l’utilità di avere a disposizione i referti del Pronto Soccorso o del 118 che documentino la reazione anafilattica, assieme al dosaggio della triptasi in fase acuta e in fase di benessere.
E’ opportuno infine considerare tutte le condizioni che si pongono in diagnosi differenziale con l’anafilassi (figura 4 ). Qualora si ponga diagnosi effettiva di AI, la vaccinazione va eseguita come da procedura standard (in ambiente vaccinale normale) con osservazione prolungata di 60’ e nei pazienti affetti da asma grave in ambiente controllato.
6. ASMA BRONCHIALE NON CONTROLLATO.
I soggetti affetti da asma bronchiale devono essere adeguatamente vaccinati perché questa malattia costituisce un fattore di rischio per alcune delle patologie prevenibili con le vaccinazioni.
Nel caso l’asma bronchiale sia controllato (tabella 3) si procede con la vaccinazione standard.
Nel caso di asma bronchiale non controllato, la somministrazione del vaccino COVID-19 deve essere rimandata ed il paziente inviato a consulenza allergologica/pneumologica.
Lo specialista deve attuare i necessari provvedimenti diagnostico-terapeutici con l’obiettivo di raggiungere il controllo della malattia e consentire la vaccinazione.
Si sottolinea inoltre che nei pazienti affetti da asma grave, trattati con biologici, tale terapia non deve essere sospesa e che la vaccinazione deve essere posticipata di 48-72 h.
Infine, in caso di asma grave non controllato nonostante terapia ottimale (biologica e/o farmacologica) la vaccinazione può essere eseguita, ma in ambiente protetto, con osservazione di 60’.
Le stesse precauzioni valgono per le persone affette da asma bronchiale grave (seppur controllato) che hanno avuto reazioni anafilattiche, con manifestazioni cardio-respiratorie, dopo esposizione a qualsiasi allergene.

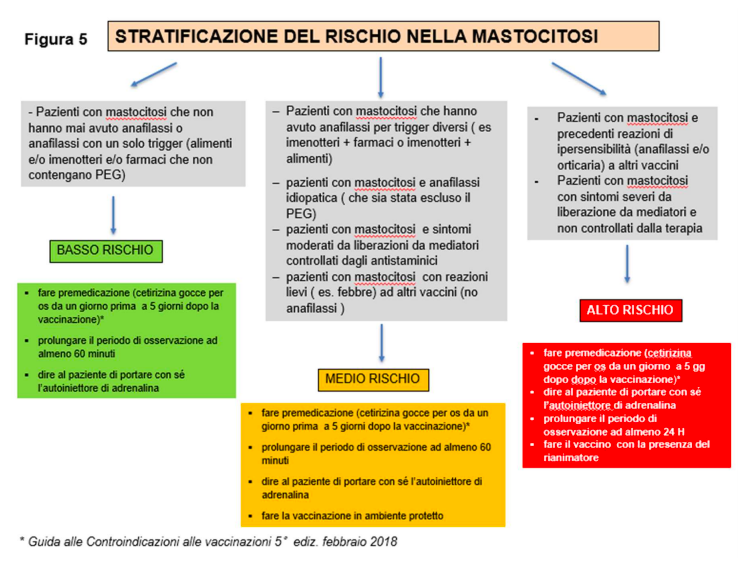
7. MASTOCITOSI.
La mastocitosi sistemica non costituisce controindicazione al vaccino. I pazienti con mastocitosi sistemica hanno tuttavia un rischio maggiore di rilascio dei mediatori dai mastociti rispetto alla popolazione generale. Solitamente l’attivazione dei mastociti e i relativi sintomi sono determinati da alcuni fattori scatenanti (punture di imenotteri, farmaci, alimenti ecc.).
In alcuni pazienti i sintomi sono molto lievi, mentre in altri possono essere gravi e richiedere una terapia continuativa con farmaci anti-mediatore (anti-H, anti H2, disodiocromoglicato e montelukast) e talvolta anche di emergenza (adrenalina), soprattutto in caso di anafilassi grave. E’ pertanto fondamentale che i pazienti con mastocitosi non interrompano la terapia di base.
I dati attualmente a disposizione relativi alle reazioni ai vaccini nei pazienti adulti affetti da mastocitosi non sembrano indicare un rischio maggiore rispetto alla popolazione generale. Dal momento però che questi soggetti hanno un rischio maggiore di rilascio aspecifico di mediatori, si suggerisce di procedere con una cautela sia per non escluderli dalla vaccinazione sia per ridurre il rischio di eventuali reazioni avverse.
La figura 5 propone una stratificazione del rischio nei pazienti affetti da mastocitosi.
VALUTAZIONE DELLE SITUAZIONI AD ALTO RISCHIO SOSPETTA REAZIONE ALLERGICA IMMEDIATA AL PEG O POLISORBATO (FARMACO INIETTABILE O VACCINO).
E’ verosimile che un componente del vaccino Pfizer-BioNTech o Moderna possa essere la causa delle reazioni anafilattiche finora segnalate al primo dosaggio.
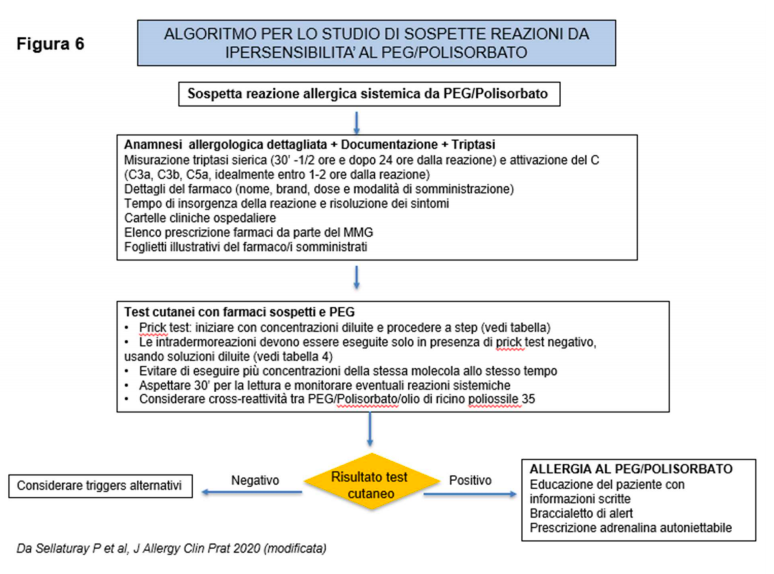
Poiché il PEG è stato segnalato come causa di anafilassi, non si può al momento escludere un suo ruolo essendo un eccipiente del vaccino sia Pfizer-BioNTech che Moderna. Il PEG ha numerosi sinonimi, di cui il più frequente è rappresentato dal macrogol.
Il PEG e i suoi derivati sono polimeri non-ionici di ossido di etilene, commercialmente disponibili in una ampia gamma di pesi molecolari (da 200 fino a 35.000 kDa) e sono contenuti in svariati farmaci, prodotti farmaceutici, cosmetici e industriali. Si segnala che anche il Cremoforo EL o olio di ricino poliossile 35 (PEG 80), una miscela di esteri triricinoleati di glicerolo etossilato con piccole quantità di polyethylenglycol (macrogol) ricinolato, viene usato come agente emulsionante e solubilizzante in alcune preparazioni farmaceutiche (es. paclitaxel).
La mancata standardizzazione della nomenclatura assieme alla inadeguata etichettatura dei prodotti contenenti PEGs (“hidden component”), è causa di una scarsa conoscenza del potenziale allergenico di questi polimeri; di conseguenza non esistono studi sulla prevalenza della ipersensibilità di tipo immediato verso i PEGs, né si conosce la sua reale incidenza.
La maggior parte delle reazioni segnalate da ipersensibilità si è verificata apparentemente alla prima esposizione al prodotto contenente PEG, suggerendo la possibilità di una sensibilizzazione latente. Il meccanismo patogenetico sembra essere per lo più di tipo IgE-mediato, come documentato dalla positività dei test allergologici su cute e su siero.
Non si possono tuttavia escludere altri meccanismi patogenetici (es. attivazione del complemento). Composti strutturalmente correlati al PEG sono i polisorbati, anch’essi ampiamente diffusi come eccipienti di formulazioni liquidi e solide di farmaci e in grado di indurre reazioni anafilattiche sia immunologicamente che non immunologicamente mediate.
E’stata evidenziata una cross-reattività tra PEG e polisorbati, di cui tenere conto nella gestione di questi pazienti. Per tutti questi motivi l’allergologo deve essere in grado di sospettare le reazioni da PEG e polisorbati ed eseguire accertamenti diagnostici idonei (figura 6). Nelle appendici 1, 2 e 3 sono riportati gli elenchi di farmaci e vaccini che contengono PEG e polisorbati, per facilitare l’approfondimento anamnestico dello specialista allergologo.
Si fa presente che si tratta di elenchi che potrebbero essere incompleti per l’ampia diffusione del PEG e dei polisorbati e per l’immissione in commercio di nuovi medicinali non disponibili al momento della preparazione del presente manoscritto.
Quando sospettare una reazione da ipersensibilità al PEG ed eseguire eventuali accertamenti allergologici?
- Pazienti con reazioni da ipersensibilità a lassativi o preparazioni per colonscopia.
- Pazienti con reazioni da ipersensibilità solo verso determinati brand o determinate dosi dello stesso farmaco.
- Pazienti con reazioni da ipersensibilità a seguito di procedure invasive o perioperatorie.
- Pazienti con reazioni da ipersensibilità verso prodotti contenenti PEG in cui è stata esclusa la sensibilizzazione verso i componenti attivi.
- Pazienti con reazioni da ipersensibilità da derivati di PEG.
DIAGNOSTICA ALLERGOLOGICA.
La figura 7 propone un algoritmo per lo studio di sospette reazioni da ipersensibilità a PEG e polisorbato.
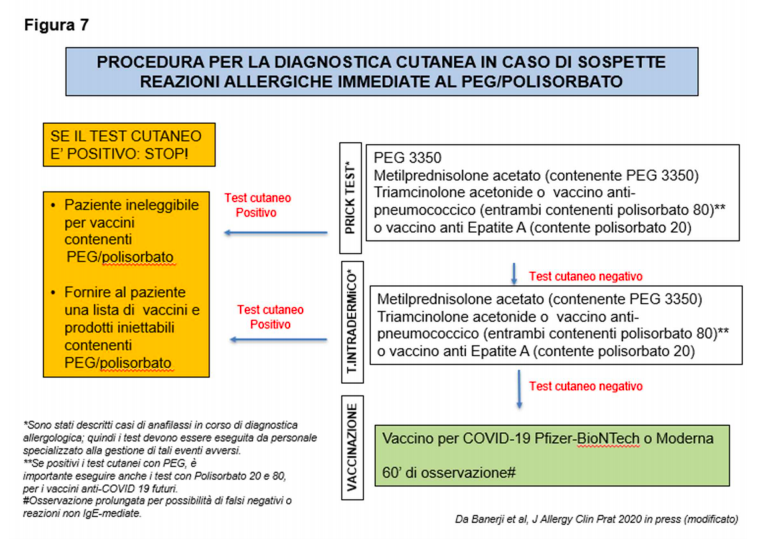
Nella pratica clinica la diagnostica allergologica si avvale dei test cutanei, dal momento che altri indagini di laboratorio (es. dosaggio su siero di IgE specifiche o test di attivazione dei basofili) sono al momento utilizzate a scopo di studio.
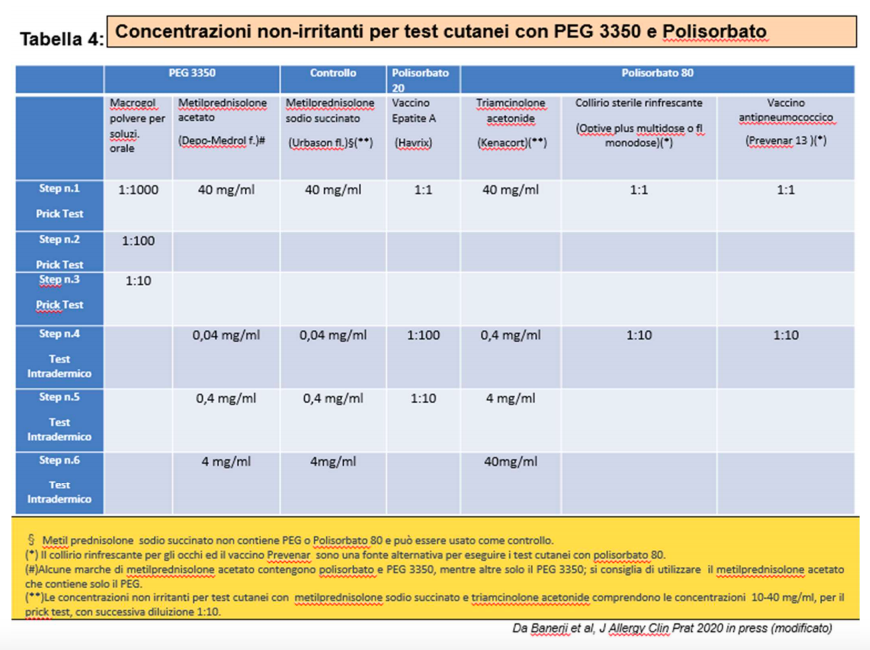
Si raccomanda di iniziare con i prick test , utilizzando concentrazioni diluite (tabella 4).
Il suo risultato può evolvere lentamente, quindi la lettura va eseguita dopo 30’ dopo il test.
In particolare al fine di facilitare la diagnostica e considerando che i produttori di materia prima forniscono unicamente PEG 4000, suggeriamo di utilizzare la formulazione commerciale di PEG 3350 (tabella 5) poichè è quella più vicina al PEG 2000 contenuto nei vaccini Pfizer BioNTech e Moderna.
E’ preferibile utilizzare formulazioni commerciali prive di solfiti e di aromi (Pediapax polvere, Movicol senza aromi, Plenvu polvere per soluzione orale).
Le formulazioni vanno diluite secondo le indicazioni della scheda tecnica per ottenere la soluzione madre (1:1) da non usare come tale per i test cutanei.
Preparare successivamente le concentrazioni 1:10 ovvero 10% (3°step), 1:100 ovvero 1% (2° step), 1:1000 ovvero 0.1% (1° step) (Tabella 4).
Le intradermoreazioni devono essere eseguite solo in presenza di prick test negativo, usando soluzioni diluite dei farmaci riportati in tabella 4, si sconsiglia di effettuare intradermoreazioni con formulazioni commerciali di PEG se pur diluite.
Sono stati descritti casi di anafilassi in corso di diagnostica allergologica; quindi si suggerisce di evitare di eseguire più concentrazioni della stessa molecola allo stesso tempo.
Per lo stesso motivo i test devono essere effettuati da personale specializzato nella diagnostica allergologica a farmaci e nella gestione di eventi avversi.
Se i test cutanei risultano positivi al PEG, è importante eseguire anche i test con Polisorbato 20 e 80, per valutare la descritta cross-reattività e l’eventuale possibilità di utilizzare futuri vaccini antiCOVID-19.
La tabella 4 mostra le concentrazioni non irritanti per eseguire i test cutanei con PEG 3350 e polisorbato.
REAZIONE ALLERGICA IMMEDIATA DOPO LA PRIMA DOSE DI VACCINO PER COVID-19 PFIZERBIONTECH O MODERNA.
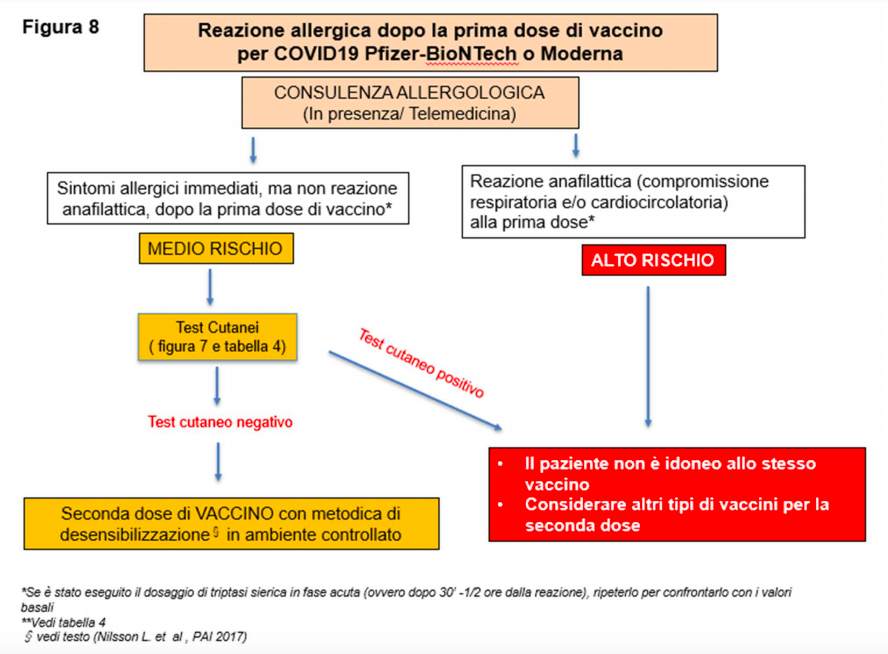
In caso di reazione allergica non anafilattica (orticaria e/o angioedema e/o prurito generalizzato e/o lieve sintomatologia respiratoria) dopo la prima dose di vaccino per COVID-19 Pfizer BioNTtech o Moderna, la consulenza allergologica prevede l’effettuazione di allergometria cutanea (figura 8 ).
In caso di positività il paziente non è idoneo alla vaccinazione; si può invece considerare di riprendere ex novo la vaccinazione utilizzando altri tipi di vaccini.

In caso di negatività dei test cutanei verso gli eccipienti PEG e polisorbato, gli estensori del documento non ritengono indicata al momento attuale l’effettuazione di test cutanei con il vaccino stesso, in assenza di dati sulla loro affidabilità diagnostica e sicurezza, mentre suggeriscono di applicare il protocollo di desensibilizzazione proposto dal Position Paper EAACI che prevede la somministrazione ad intervalli di 15-30 minuti di 0,05 ml della diluizione 1:10, successivamente 0,05 ml, 0,10 ml, 0,15 ml del vaccino indiluito.
In caso di reazione anafilattica grave, è preferibile non praticare il secondo dosaggio dello stesso vaccino ed eventualmente considerare la possibilità di riprendere ex novo la vaccinazione utilizzando altri tipi di vaccini (con eccipienti diversi, previa effettuazione di test cutanei) (figura 8).
E’ necessario eseguire una ponderata valutazione del rapporto rischio-beneficio, anche tenendo conto della possibilità di eseguire un challenge con un altro vaccino.
Non vi sono al momento dati sulla sicurezza ed efficacia di un secondo vaccino dopo una reazione anafilattica alla prima dose.
Si ribadisce l’utilità di eseguire il dosaggio di triptasi in fase acuta (ovvero dopo 30’-1/2 ore dall’evento) con sua ripetizione in condizioni basali.
Si considera significativo un aumento della triptasi se la triptasi in acuto risulta > della (triptasi basale x 1.2) + 2.
Si fa presente infine la necessità di segnalare alle Autorità competenti la reazione avversa dopo vaccinazione per COVID-19; la segnalazione può avvenire online anche attraverso la piattaforma Vigifarma collegandosi al sito www.vigifarma.it.
Si suggerisce inoltre di segnalare i casi di reazioni allergiche al vaccino per COVID-19 all’allergologo operante in strutture idonee alla effettuazione di diagnostica allergologica cutanea.
CENTRO VACCINALE IN ALLERGOLOGIA (AMBIENTE PROTETTO).
Dalla circolare del Ministero della Salute sulle Raccomandazioni per l’organizzazione della campagna vaccinale contro SARS-CoV-2/COVID-19 e procedure di vaccinazione emerge il ruolo del personale medico: “Il personale medico coordina ed è responsabile degli Ambulatori Vaccinali di riferimento, sovraintende la raccolta dell’anamnesi pre-vaccinale e del consenso informato nel Punto di Accettazione e supervisiona la preparazione e la somministrazione dei vaccini e l’osservazione dei soggetti, nelle eventuali valutazioni/complicazioni cliniche. Il personale medico dovrà essere sempre garantito per ogni Punto Vaccinazione Ospedaliero o Territoriale”.
La sede di vaccinazione in ambiente protetto deve essere ubicata in ospedale, ove sia presente sala adibita o adibibile a manovre rianimatorie. Dovrà essere reperibile il Collega Anestesista – Rianimatore. Dovrà essere presente personale infermieristico per la collaborazione del caso, accesso venoso, infusione di farmaci e somministrazione di ossigeno, manovre rianimatorie.
L’ambiente protetto dovrà disporre di spazi adeguati, di carrello delle emergenze attrezzato come da tabelle 1 e 2 allegata per quanto riguarda presidi e farmaci.
I pazienti andranno opportunamente valutati per i loro parametri vitali, comprensivi di PA e SAT O2. In base a score di gravità stabilito e considerazioni cliniche individuali si valuterà la eventuale opportunità prima della somministrazione del vaccino di accesso venoso.
Nel caso in cui sia l’allergologo o personale infermieristico / assistente sanitario dell’ambulatorio allergologico a dover somministrare personalmente il vaccino, tali professionisti dovranno essere adeguatamente educati alla somministrazione, servendosi per la preparazione del vaccino e per la sua somministrazione dei tutorials già forniti dal Ministero della Salute.

In caso di negatività dei test cutanei verso gli eccipienti PEG e polisorbato, gli estensori del documento non ritengono indicata al momento attuale l’effettuazione di test cutanei con il vaccino stesso, in assenza di dati sulla loro affidabilità diagnostica e sicurezza, mentre suggeriscono di applicare il protocollo di desensibilizzazione proposto dal Position Paper EAACI che prevede la somministrazione ad intervalli di 15-30 minuti di 0,05 ml della diluizione 1:10, successivamente 0,05 ml, 0,10 ml, 0,15 ml del vaccino indiluito.
In caso di reazione anafilattica grave, è preferibile non praticare il secondo dosaggio dello stesso vaccino ed eventualmente considerare la possibilità di riprendere ex novo la vaccinazione utilizzando altri tipi di vaccini (con eccipienti diversi, previa effettuazione di test cutanei) (figura 8).
E’ necessario eseguire una ponderata valutazione del rapporto rischio-beneficio, anche tenendo conto della possibilità di eseguire un challenge con un altro vaccino.
Non vi sono al momento dati sulla sicurezza ed efficacia di un secondo vaccino dopo una reazione anafilattica alla prima dose. Si ribadisce l’utilità di eseguire il dosaggio di triptasi in fase acuta (ovvero dopo 30’-1/2 ore dall’evento) con sua ripetizione in condizioni basali.
Si considera significativo un aumento della triptasi se la triptasi in acuto risulta > della (triptasi basale x 1.2) + 2.
Si fa presente infine la necessità di segnalare alle Autorità competenti la reazione avversa dopo vaccinazione per COVID-19; la segnalazione può avvenire online anche attraverso la piattaforma Vigifarma collegandosi al sito www.vigifarma.it . Si suggerisce inoltre di segnalare i casi di reazioni allergiche al vaccino per COVID-19 all’allergologo operante in strutture idonee alla effettuazione di diagnostica allergologica cutanea.
Bibliografia.
- Guida alle controindicazioni alle vaccinazioni Quinta edizione; febbraio 2018. A cura di: Giovanni Gallo, Rosanna Mel, Elisa Ros e Antonietta Filia. Allegato al parere del Consiglio Superiore di Sanità del 23 marzo 2018.
- Banerji A, et al. mRNA Vaccines to Prevent COVID-19 Disease and Reported Allergic Reactions: Current Evidence and Approach. J Allergy Clin Immunol In Practice. In press.
- Castells M, et al. Maintaining Safety with SARS-CoV-2 Vaccines. N Engl J Med. 2020 Dec 30. On line ahead of print.
- Alm J, et al. Vaccination and allergy: EAACI position paper, practical aspects. Pediatr Allergy Immunol. 2017;28:628- 640.
- Klimek L, et al. ARIA-EAACI statement on severe allergic reactions to COVID-19 vaccines – an EAACI-ARIA position paper. Allergy. 2020 Dec 30. On line ahead of print.
- Valent P, et al. Risk and management of patients with mastocytosis and MCAS in the SARS-CoV-2 (COVID-19) pandemic: Expert opinions. J Allergy Clin Immunol. 2020;146:300-306.
- Zanoni G, et al. Vaccination management in children and adults with mastocytosis. Clin Exp Allergy. 2017;47:593- 596.
- Strategia Globale per la Gestione e la Prevenzione dell’Asma, Aggiornamento 2019 (LINK).
- Calogiuri G, Foti C, Nettis E, Di Leo E, Macchia L, Vacca A. Polyethylene glycols and polysorbates: Two still neglected ingredients causing true IgE-mediated reactions. J Allergy Clin Immunol Pract. 2019 Sep-Oct;7(7):2509-2510.
- Bilò MB, Martini M, Tontini C, Mohamed OE, Krishna MT. Idiopathic anaphylaxis. Clin Exp Allergy. 2019 Jul;49(7):942- 952.
- Wenande E, Garvey LH. Immediate-type hypersensitivity to polyethylene glycols: a review. Clin Exp Allergy. 2016;46:907-22.
- Cardona V, et al. World allergy organization anaphylaxis guidance 2020. World Allergy Organ J. 2020;13:100472.
- Muraro A et al. Anaphylaxis: guidelines from the European Academy of Allergy and Clinical Immunology. Allergy. 2014;69:1026-45.
- Cabanillas B, Akdis C, Novak N. Allergic reactions to the first COVID-19 vaccine: a potential role of Polyethylene glycol? Allergy. 2020 Dec 15.
- Sellaturay P, Nasser S, Ewan P. Polyethylene Glycol-Induced Systemic Allergic Reactions (Anaphylaxis). J Allergy Clin Immunol Pract. 2020 Oct 1:S2213-2198(20)31007-2.
- Zhou ZH, Stone CA Jr, Jakubovic B, Phillips EJ, Sussman G, Park J, Hoang U, Kirshner SL, Levin R, Kozlowski S. AntiPEG IgE in anaphylaxis associated with polyethylene glycol. J Allergy Clin Immunol Pract. 2020 Nov 17:S2213- 2198(20)31231-9.
- Kozma GT, Shimizu T, Ishida T, Szebeni J. Anti-PEG antibodies: Properties, formation, testing and role in adverse immune reactions to PEGylated nano-biopharmaceuticals. Adv Drug Deliv Rev. 2020;154-155:163-175.
- Lu IN, Rutkowski K, Kennard L, Nakonechna A, Mirakian R, Wagner A. Polyethylene glycol may be the major allergen in depot medroxy-progesterone acetate. J Allergy Clin Immunol Pract. 2020 Oct;8(9):3194-3197.
- Stone CA Jr, Liu Y, Relling MV, Krantz MS, Pratt AL, Abreo A, Hemler JA, Phillips EJ. Immediate Hypersensitivity to Polyethylene Glycols and Polysorbates: More Common Than We Have Recognized. J Allergy Clin Immunol Pract. 2019 May-Jun;7(5):1533-1540.e8.
- Bonadonna P, Scaffidi L. Hymenoptera Anaphylaxis as a Clonal Mast Cell Disorder. Immunol Allergy Clin North Am. 2018 Aug;38(3):455-468.
- Alvarez-Twose I, González-de-Olano D, Sánchez-Muñoz L, Matito A, Jara-Acevedo M, TeodosioC, García-Montero A, Morgado JM, Orfao A, Escribano L Validation of the REMA score for predicting mast cell clonality and systemic mastocytosis in patients with systemic mast cell activation symptoms. Int Arch Allergy Immunol. 2012;157(3):275-8.
- Valent P. Risk factors and management of severe life-threatening anaphylaxis in patients with clonal mast cell disorders. Clin Exp Allergy. 2014;44(7):914-920.
- Weiler CR, Austen KF, Akin C, Barkoff MS, Bernstein JA, Bonadonna P, Butterfield JH, Carter M, Fox CC, Maitland A, Pongdee T, Mustafa SS, Ravi A, Tobin MC, Vliagoftis H, Schwartz LB. AAAAI Mast Cell Disorders Committee Work Group Report: Mast cell activation syndrome (MCAS) diagnosis and management. J Allergy Clin Immunol. 2019;144(4):883-896.
- Valent P, Akin C, Bonadonna P, Brockow K, Niedoszytko M, Nedoszytko B, Butterfield JH, Alvarez-Twose I, Sotlar K, Schwaab J, Jawhar M, Reiter A, Castells M, Sperr WR, Kluin-Nelemans HC, Hermine O, Gotlib J, Zanotti R, BroesbyOlsen S, Horny HP, Triggiani M, Siebenhaar F, Orfao A, Metcalfe DD, Arock M, Hartmann K. Risk and management of patients with mastocytosis and MCAS in the SARS-CoV-2 (COVID-19) pandemic: Expert opinions. J Allergy Clin Immunol. 2020;146(2):300-306.
- Nilsson L, Brockow K, Alm J, Cardona V, Caubet JC, Gomes E, Jenmalm MC, Lau S, Netterlid E, Schwarze J, Sheikh A, Storsaeter J, Skevaki C, Terreehorst I, Zanoni G. Vaccination and allergy: EAACI position paper, practical aspects. Pediatr Allergy Immunol. 2017 Nov;28(7):628-640



[…] Vaccino anti-Covid: gestione dei Pazienti a rischio allergie ed eventi avversi. proviene da AssoCareNews.it – Quotidiano Sanitario […]
[…] Vaccino anti-Covid: gestione dei Pazienti a rischio allergie ed eventi avversi. proviene da AssoCareNews.it – Quotidiano Sanitario […]